HEMLIBRA 150 mg-mL, solution injectable, boîte de 1 flacon de 0,40 mL
Dernière révision : 27/05/2024
Taux de TVA : 2.1%
Prix de vente : 3 323,84 €
Taux remboursement SS : 100%
Base remboursement SS : 3 323,84 €
Laboratoire exploitant : ROCHE
Hemlibra est indiqué en prophylaxie pour prévenir les épisodes hémorragiques chez les patients atteints d'hémophilie A (déficit congénital en facteur VIII) :
- avec inhibiteurs anti-facteur VIII
- sans inhibiteur anti-facteur VIII qui ont :
- une forme sévère (FVIII < 1 %)
- une forme modérée (FVIII ≥ 1 % et ≤ 5 %) avec un phénotype hémorragique sévère.
Hemlibra peut être utilisé dans toutes les tranches d'âge.
Hypersensibilité à la substance active ou à l'un des excipients mentionnés à la rubrique Liste des excipients.
Traçabilité
Afin d'améliorer la traçabilité des médicaments biologiques, le nom de la spécialité et le numéro de lot du produit administré doivent être clairement inscrits dans le dossier du patient.
Microangiopathie thrombotique associée à Hemlibra et à l'aPCC
Des cas de microangiopathie thrombotique (MAT) ont été rapportés dans une étude clinique menée chez des patients recevant une prophylaxie par Hemlibra, lorsqu'une dose cumulée moyenne > 100 U/kg/24 heures d'aPCC a été administrée pendant 24 heures ou plus (voir rubrique Effets indésirables). Le traitement des MAT prévoyait un traitement symptomatique avec ou sans plasmaphérèse et hémodialyse. Des signes d'amélioration de la MAT ont été observés dans la semaine ayant suivi l'arrêt d'aPCC et l'interruption d'Hemlibra. Cette amélioration rapide diffère de l'évolution clinique habituelle observée dans le syndrome hémolytique et urémique atypique (SHUa) et les MAT classiques, notamment le purpura thrombotique thrombocytopénique (PTT) (voir rubrique Effets indésirables). Après résolution de la MAT, Hemlibra a été réintroduit chez un patient, qui a continué à être traité en toute sécurité.
Le développement éventuel d'une MAT doit être surveillé lors de l'administration d'aPCC chez les patients recevant une prophylaxie par Hemlibra. Le médecin doit immédiatement arrêter l'aPCC et interrompre le traitement par Hemlibra si des symptômes cliniques et/ou des résultats biologiques évoquant une MAT surviennent, et initier une prise en charge appropriée. Les médecins et les patients/aidants doivent évaluer au cas par cas les bénéfices et les risques d'une reprise de la prophylaxie par Hemlibra après résolution complète de la MAT. Dans le cas où un agent by-passant est indiqué chez un patient recevant une prophylaxie par Hemlibra, merci de vous reporter au paragraphe ci-dessous sur les recommandations posologiques relatives à l'utilisation des agents by- passants.
Des précautions doivent être prises lors du traitement des patients qui sont à haut risque de MAT (par exemple, patients ayant des antécédents médicaux ou des antécédents familiaux de MAT), ou ceux qui reçoivent des médicaments concomitants connus pour être un facteur de risque de développement d'une MAT (par exemple ciclosporine, quinine, tacrolimus).
Thromboembolie associée à Hemlibra et à l'aPCC
Des événements thrombotiques graves ont été rapportés au cours d'une étude clinique menée chez des patients recevant une prophylaxie par Hemlibra lorsqu'une dose cumulée moyenne > 100 U/kg/24 heures d'aPCC a été administrée pendant 24 heures ou plus (voir rubrique Effets indésirables). Aucun cas n'a nécessité de traitement anticoagulant. Après l'arrêt d'aPCC et l'interruption d'Hemlibra, des signes d'amélioration ou de résolution ont été observés dans le mois qui a suivi (voir rubrique Effets indésirables). Hemlibra
a été réintroduit chez un patient après résolution de l'événement thrombotique, qui a continué à être traité en toute sécurité.
Le développement d'une thromboembolie doit être surveillé chez les patients recevant une prophylaxie par Hemlibra lors de l'administration d'aPCC. Le médecin doit immédiatement arrêter l'aPCC et interrompre le traitement par Hemlibra si des symptômes cliniques, des résultats d'imagerie et/ou biologiques évoquant des événements thrombotiques se produisent, et doit initier une prise en charge appropriée. Les médecins et les patients/ aidants doivent examiner au cas par cas les bénéfices et les risques d'une reprise de la prophylaxie par Hemlibra après résolution complète des événements thrombotiques. Dans le cas où un agent by-passant est indiqué chez un patient recevant une prophylaxie par Hemlibra, merci de vous reporter au paragraphe ci-dessous sur les recommandations posologiques relatives à l'utilisation des agents by-passants.
Recommandations relatives à l'utilisation des agents by-passants chez les patients recevant uneprophylaxie par Hemlibra
Le traitement par des agents by-passants doit être interrompu la veille de l'instauration du traitement par Hemlibra.
Les médecins doivent discuter systématiquement avec leurs patients et/ou les aidants de la dose exacte et du schéma d'administration des agents by-passants à utiliser, s'ils s'avéraient nécessaires pendant la prophylaxie par Hemlibra.
Hemlibra augmente la capacité de coagulation du patient. La dose d'agent by-passant nécessaire peut par conséquent être inférieure à celle utilisée en l'absence de prophylaxie par Hemlibra. La posologie et la durée du traitement par agents by-passants dépendront de la localisation et de la sévérité du saignement et de l'état clinique du patient. L'utilisation d'aPCC doit être évitée, sauf si aucune autre option ou alternative thérapeutique n'est disponible. Si l'aPCC est utilisé chez un patient recevant une prophylaxie par Hemlibra, la posologie initiale ne doit pas dépasser 50 U/kg et une surveillance biologique (comprenant au moins une surveillance de la fonction rénale et de la numération plaquettaire ainsi qu'une évaluation de la thrombose) est recommandée. Si le saignement n'est pas contrôlé avec une dose initiale d'aPCC ≤ 50 U/kg, les doses supplémentaires d'aPCC doivent être administrées sous surveillance ou contrôle médical, incluant la surveillance biologique afin de diagnostiquer une MAT ou tout événement thrombotique. Une surveillance du ou des saignements est nécessaire avant toute nouvelle administration d'aPCC. La dose totale d'aPCC ne doit pas dépasser 100 U/kg au cours des premières 24 heures de traitement. Les médecins doivent évaluer avec précaution les risques de MAT et de thromboembolie par rapport au risque hémorragique s'ils envisagent de poursuivre le traitement par aPCC au-delà de la dose maximale de 100 U/kg au cours des 24 premières heures.
Au cours des études cliniques, aucun cas de MAT ni d'événements thrombotiques n'a été observé avec la seule utilisation du rFVIIa chez les patients recevant une prophylaxie par Hemlibra.
Les recommandations posologiques des agents by-passants doivent continuer à être respectées pendant au moins six mois après l'arrêt de la prophylaxie par Hemlibra (voir rubrique Propriétés pharmacocinétiques).
Immunogénicité
Le développement d'anticorps anti-emicizumab neutralisants associés à une diminution de la concentration d'emicizumab entraînant une perte d'efficacité a été observé peu fréquemment au cours des études cliniques (voir rubriques Effets indésirables et Propriétés pharmacodynamiques). Les patients présentant des signes cliniques de perte d'efficacité (par exemple, augmentation des événements hémorragiques intercurrents) doivent être rapidement évalués afin d'en déterminer l'étiologie et d'autres options thérapeutiques doivent être envisagées si des anticorps anti-emicizumab neutralisants sont suspectés.
Effets d'emicizumab sur les tests de coagulation
Emicizumab restaure l'activité co-facteur du facteur VIII activé (FVIIIa) manquant dans la formation du complexe ténase. Les tests de coagulation basés sur la voie intrinsèque de la coagulation, dont le temps de coagulation activé (ACT), le temps de céphaline activée (type TCA), mesurent le temps de coagulation total, notamment le temps nécessaire pour l'activation du FVIII en FVIIIa par la thrombine. Ces tests explorant la voie intrinsèque donnent des temps de coagulation très raccourcis en présence d'emicizumab, puisqu'ils ne nécessitent pas d'activation par la thrombine. Le temps de coagulation de la voie intrinsèque très raccourci interfère ensuite dans tous les tests de dosage différentiel des facteurs de coagulation basés sur le TCA, notamment le dosage chronométrique de l'activité du FVIII (voir rubrique Mises en garde spéciales et précautions d'emploi, Tableau 1). Cependant les tests de dosage différentiel des facteurs de coagulation utilisant des méthodes chromogéniques ou immunologiques ne sont pas perturbés par emicizumab. Ils peuvent donc être utilisés pour évaluer les paramètres de la coagulation pendant le traitement, avec une attention particulière pour les tests de mesure chromogénique de l'activité du FVIII, comme indiqué ci-dessous.
Les tests de mesure chromogénique de l'activité du FVIII peuvent utiliser des protéines de coagulation humaines ou bovines. Les tests utilisant des facteurs de coagulation d'origine humaine réagissent à emicizumab, et peuvent surestimer le potentiel hémostatique clinique d'emicizumab. En revanche, les tests utilisant des facteurs de coagulation d'origine bovine sont insensibles à emicizumab (aucune activité mesurée) et peuvent être utilisés pour surveiller l'activité du FVIII endogène ou perfusé, ou pour titrer les inhibiteurs anti-FVIII.
Emicizumab reste actif en présence d'inhibiteurs anti-FVIII, et entraînera ainsi un résultat faussement négatif dans les tests utilisant les méthodes de Bethesda basées sur l'inhibition fonctionnelle du FVIII (dosage chronométrique). En revanche, la méthode de Bethesda adaptée à la mesure de l'activité chromogénique du FVIII (méthode Bethesda chromogénique) avec des réactifs d'origine bovine est insensible à emicizumab et pourra être utilisée.
Ces deux marqueurs pharmacodynamiques ne reflètent pas l'effet hémostatique réel d'emicizumab in vivo (le TCA est très raccourci et l'activité rapportée du FVIII peut être surestimée), mais fournissent une indication relative de l'effet pro-coagulant d'emicizumab.
En résumé, chez les patients traités par Hemlibra, les résultats des tests de laboratoire basés sur la voie intrinsèque de la coagulation ne doivent pas être utilisés pour surveiller l'activité d'emicizumab, ni pour déterminer le dosage du facteur de substitution ou du facteur anticoagulant ni pour titrer les inhibiteurs anti-FVIII. Des précautions doivent être prises si des tests de laboratoire basés sur la voie intrinsèque de la coagulation sont utilisés, en raison du risque de mauvaise interprétation de ces résultats qui pourrait conduire à une prise en charge sous-optimale des patients présentant des épisodes hémorragiques, pouvant potentiellement aboutir à des saignements sévères ou des saignements engageant le pronostic vital des patients.
Les tests biologiques modifiés et non modifiés par emicizumab sont présentés dans le Tableau 1 ci- dessous. Compte tenu de la demi-vie prolongée d'emicizumab, ces effets sur les tests de coagulation peuvent persister jusqu'à six mois après la dernière dose (voir rubrique Propriétés pharmacocinétiques).
Tableau 1 Résultats des tests de coagulation modifiés ou non par emicizumab
| Résultats modifiés par emicizumab | Résultats non modifiés par emicizumab |
| - Temps de céphaline activée (TCA) - Recherche et titrage de l’inhibiteur anti FVIII par la méthode Bethesda (basée sur la mesure du FVIII : C en 1 temps) - Dosages chronométriques des facteurs de coagulation basés sur le TCA - Résistance à la protéine C activée (RPCa) basée sur le TCA - Temps de coagulation activé (ACT) | - Recherche et titrage de l’inhibiteur anti FVIII par la méthode de Bethesda utilisant un test chromogénique avec des réactifs d’origine bovine - Temps de thrombine (TT) - Dosages chronométriques des facteurs de coagulation basés sur le taux de prothrombine - Dosages chromogéniques d’un seul facteur, autre que le FVIII1 - Dosages immunologiques (ex : ELISA, méthodes immunoturbidimétriques) - Analyse moléculaire des facteurs de coagulation (exemple : Facteur V Leiden, Prothrombin G20210A) |
1 Pour des considérations importantes concernant les dosages chromogéniques du FVIII, voir rubrique Mises en garde spéciales et précautions d'emploi.
Population pédiatrique :
Il n'y a pas de données disponibles chez les nourrissons âgés de < 1 an. Le développement du système hémostatique chez les nouveau-nés et les nourrissons étant dynamique et évolutif, les concentrations relatives de protéines pro- et anticoagulantes chez ces patients doivent être prises en compte lors de l'évaluation du rapport bénéfice-risque, qui devra également tenir compte du risque potentiel de thrombose (par exemple thrombose de la chambre implantable).
Résumé du profil de sécurité
Le profil général de sécurité d'Hemlibra est basé sur des données issues des études cliniques et de la surveillance post-commercialisation. Les effets indésirables les plus graves rapportés au cours des études cliniques sur Hemlibra ont été la survenue d'épisodes de microangiopathie thrombotique (MAT) et d'événements thrombotiques, notamment thrombose du sinus caverneux et thrombose des veines superficielles concomitante à une nécrose cutanée (voir ci-dessous et rubrique Mises en garde spéciales et précautions d'emploi).
Les effets indésirables les plus fréquents, rapportés chez au moins 10 % des patients ayant reçu au moins une dose d'Hemlibra, ont été les suivants : réactions au site d'injection (19,4 %), arthralgies (14,2 %) et céphalées (14,0 %).
Au total trois patients (0,7 %) ayant reçu une prophylaxie par Hemlibra au cours des études cliniques ont arrêté le traitement à la suite des effets indésirables suivants : MAT, nécrose cutanée concomitante avec une thrombophlébite superficielle, et céphalées.
Tableau des effets indésirables
Les effets indésirables suivants sont issus de la surveillance post-commercialisation et des données regroupées de cinq études cliniques de phase III (trois études menées chez l'adulte et l'adolescent [BH29884 - HAVEN 1, BH30071 - HAVEN 3, et BO39182 - HAVEN 4], une étude menée chez des patients appartenant à tous les groupes d'âge [BO41423 - HAVEN 6] et une étude pédiatrique [BH29992 - HAVEN 2]), au cours desquelles un total de 444 patients atteints d'hémophilie A ont reçu au moins une dose d'Hemlibra en prophylaxie (voir rubrique Propriétés pharmacodynamiques). Trois cent sept (69,1 %) participants aux études cliniques étaient des adultes (parmi lesquels deux femmes), 61 (13,7 %) étaient des adolescents (≥ 12 à < 18 ans), 71 (16,0 %) étaient des enfants (âgés de ≥ 2 à < 12 ans) et cinq (1,1 %) étaient des nourrissons et jeunes enfants (âgés de 1 mois à < 2 ans). La durée médiane d'exposition pendant les études a été de 32 semaines (entre 0,1 et 94,3 semaines).
Les effets indésirables survenus au cours des études cliniques de phase III et de la surveillance post- commercialisation sont présentés par classes de systèmes d'organes MedDRA (Tableau 2). Les catégories de fréquences correspondantes pour chaque effet secondaire sont définies comme suit : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à
< 1/1 000), très rare (< 1/10 000) et fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Tableau 2 Résumé des effets indésirables survenus au cours de l'ensemble des études cliniques HAVEN (« données poolées ») et de la surveillance post-commercialisation d'Hemlibra
| Système Organe-Classe (SOC) | Effets indésirables (PT classification MedDRA) | Fréquence |
| Affections hématologiques et du systèmelymphatique | Microangiopathie thrombotique | Peu fréquent |
| Affections du système nerveux | Céphalée | Très fréquent |
| Affections vasculaires | Thrombophlébite superficielle | Peu fréquent |
| Thrombose du sinus caverneuxa | Peu fréquent | |
| Affections gastro-intestinales | Diarrhée | Fréquent |
| Affections de la peau et du tissu sous-cutané | Nécrose cutanée | Peu fréquent |
| Angioedème | Peu fréquent | |
| Urticaire | Fréquent | |
| Rash | Fréquent | |
| Affections musculo-squelettiques et systémiques | Arthralgie | Très fréquent |
| Myalgie | Fréquent | |
| Troubles généraux et anomalies au site d'administration | Réaction au site d'injection | Très fréquent |
| Pyrexie | Fréquent | |
| Diminution de la réponse thérapeutiqueb | Peu fréquent | |
| a « Affections vasculaires » est un SOC secondaire pour la thrombose du sinus caverneux. b Une perte d'efficacité (diminution de la réponse thérapeutique) se manifestant par une augmentation des saignements intercurrents a été rapportée avec les anticorps anti-emicizumab neutralisants associés à une diminution de la concentration d'emicizumab (voir la description d'effets indésirables sélectionnés et les rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques). | ||
Description d'effets indésirables sélectionnés
Microangiopathie thrombotique
Dans l'ensemble des études cliniques de phase III, des MAT ont été rapportées chez moins de 1 % des patients (3/444) et chez 9,7 % des patients (3/31) qui ont reçu au moins une dose d'aPCC lors du traitement par emicizumab. Les 3 cas de MAT sont survenus lorsqu'une dose cumulée moyenne d'aPCC supérieure à 100 U/kg/24 heures a été administrée pendant 24 heures ou plus pour traiter un épisode hémorragique (voir rubrique Mises en garde spéciales et précautions d'emploi). Les patients ont présenté une thrombocytopénie, une anémie hémolytique microangiopathique et une insuffisance rénale aiguë, sans déficit sévère de l'activité de l'ADAMTS13. Un patient a repris le traitement par Hemlibra suite à la disparition de la MAT, sans récidive de celle-ci.
Événements thrombotiques
Dans l'ensemble des études cliniques de phase III, des événements thrombotiques graves ont été rapportés chez moins de 1 % des patients (2/444) et chez 6,5 % des patients (2/31) qui ont reçu au moins une dose d'aPCC lors du traitement par emicizumab. Les 2 cas d'événements thrombotiques graves sont survenus lorsqu'une dose cumulée moyenne d'aPCC supérieure à 100 U/kg/24 heures a été administrée pendant 24 heures ou plus pour traiter un épisode hémorragique. Un patient a repris le traitement par Hemlibra suite à la disparition des événements thrombotiques, sans récidive de ceux-ci (voir rubrique Mises en garde spéciales et précautions d'emploi).
Caractérisation de l'interaction entre l'emicizumab et le traitement par aPCC au cours des étudescliniques pivots
Parmi les 82 cycles de traitement par aPCC* chez les patients traités par Hemlibra en prophylaxie, huit (10 %) ont consisté en l'administration d'une dose cumulée moyenne d'aPCC > 100 U/kg/24 heures pendant 24 heures ou plus. Deux de ces 8 cycles de traitement ont été associés à des événements thrombotiques et 3 de ces 8 cycles ont été associés à une microangiopathie thrombotique (Tableau 3). Aucune MAT ni événement thrombotique n'ont été observés dans les autres cas de traitement par aPCC. Parmi tous les cycles de traitement par aPCC, 68 % consistaient en une seule perfusion inférieure à 100 U/kg.
Tableau 3 Détails des cycles de traitement par aPCC* dans l'ensemble des études cliniques de phase III (« données poolées »)
| Durée du traitement par aPCC | Dose cumulée moyenne d'aPCC sur 24 heures (U/kg/24 heures) | ||
| <50 | 50-100 | >100 | |
| <24 heures | 9 | 47 | 13 |
| 24-48 heures | 0 | 3 | 1b |
| >48 heures | 1 | 1 | 7a,a,a,b |
* Un cycle de traitement par aPCC est défini comme l'ensemble des doses d'aPCC reçues par un patient, quelle qu'en soit la raison, se terminant dès que l'interruption de traitement dépasse 36 heures. Sont inclus tous les cycles de traitement par aPCC, à l'exception de ceux reçus dans les 7 premiers jours de traitement par Hemlibra et de ceux administrés dans les 30 jours suivant l'arrêt du traitement par Hemlibra.
a Microangiopathie thrombotique
b Événement thrombotique
Réactions au site d'injection
Des réactions au site d'injection ont été rapportées très fréquemment (19,4 %) au cours de l'ensemble des études cliniques de phase III (« données poolées »). Toutes les réactions au site d'injection observées au cours des études cliniques sur Hemlibra ont été considérées comme non graves et d'intensité légère à modérée et 94.9 % ont été résolues sans traitement. Les symptômes les plus fréquemment rapportés comme associés à ces réactions ont été : érythème au site d'injection (10,6 %), douleur au site d'injection (4,1 %), prurit au site d'injection (2,9 %) et gonflement au site d'injection (2,7 %).
Immunogénicité
Dans l'ensemble des études cliniques de phase III réalisées avec Hemlibra (« données poolées »), le développement d'anticorps anti-emicizumab neutralisants associés à une diminution de la concentration d'emicizumab était peu fréquent (voir rubrique Propriétés pharmacodynamiques). Un patient, qui a développé des anticorps anti-emicizumab neutralisants avec une diminution de la concentration d'emicizumab, a présenté une perte d'efficacité (qui s'est manifestée par des saignements intercurrents) après cinq semaines de traitement et a ensuite arrêté le traitement par Hemlibra (voir rubriques Mises en garde spéciales et précautions d'emploi et Propriétés pharmacodynamiques).
Population pédiatrique
La population pédiatrique étudiée comprend un total de 137 patients, parmi lesquels 5 (3,6 %) nourrissons et jeunes enfants (1 mois à < 2 ans), 71 (51,8 %) enfants (≥ 2 ans à < 12 ans) et 61 (44,5 %) adolescents (≥ 12 ans à < 18 ans). Le profil de sécurité d'Hemlibra a été globalement similaire chez les nourrissons, les enfants, les adolescents et les adultes.
Déclaration des effets indésirables suspectés
La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - voir Annexe V.
Le développement d'anticorps anti-emicizumab neutralisants associés à
une diminution de la concentration d'emicizumab entraînant une perte
d'efficacité a été observé peu fréquemment au cours des études
cliniques. Evaluer les patients présentant des signes cliniques de
perte d'efficacité (par exemple, augmentation des événements
hémorragiques intercurrents) afin d'en déterminer l'étiologie et
envisager d'autres options thérapeutiques si des anticorps
anti-emicizumab neutralisants sont suspectés.
Effets d'emicizumab sur les tests de coagulation
Chez les patients traités par emicizumab,
les résultats des tests de laboratoire basés sur la voie intrinsèque de
la coagulation ne doivent pas être utilisés pour surveiller l'activité
d'emicizumab, ni pour déterminer le dosage du facteur de substitution
ou du facteur anticoagulant ni pour titrer les inhibiteurs antifacteur
VIII.
Les tests biologiques modifiés par emicizumab, qui peuvent persister
jusqu'à six mois après la dernière dose (compte tenu de la demi-vie
prolongée d'emicizumab) sont :
- Temps de céphaline activée (TCA).
- Recherche et titrage de l'inhibiteur anti FVIII par la méthode Bethesda (basée sur la mesure du FVIII : C en 1 temps).
- Dosages chronométriques des facteurs de coagulation basés sur le TCA.
- Résistance à la protéine C activée (RPCa) basée sur le TCA.
- Temps de coagulation activé (ACT).
SURVEILLANCE du traitement lors de l'administration l'aPCC: Le médecin doit immédiatement arrêter l'aPCC et interrompre le traitement :
- si des symptômes cliniques et/ou des résultats biologiques évoquant une MAT surviennent, et initier une prise en charge appropriée.
- si des
symptômes cliniques, des résultats d'imagerie et/ou biologiques évoquant des
événements thrombotiques se produisent, et doit initier une prise en charge
appropriée.
ARRETER LE TRAITEMENT ET PREVENIR IMMEDIATEMENT UN MEDECIN en cas de :
- Confusion, faiblesse, gonflement des bras et des jambes, jaunissement de la peau et des yeux, douleur vague au niveau du ventre (abdomen) ou du dos, mal au coeur (nausées), vomissements ou diminution de la quantité d'urine.
- Gonflement, chaleur, douleur ou rougeur, maux de tête, engourdissement du visage, douleur ou gonflement au niveau des yeux ou altération de la vision, noircissement de la peau.
CONTACTER IMMEDIATEMENT UN MEDECIN si les saignements ne sont pas contrôlés avec la dose prescrite.
FEMMES EN AGE DE PROCREER : UTILISER une contraception efficace pendant et au moins six mois après l'arrêt du traitement.
NE PAS réaliser l'injection sous-cutanée dans les zones où la peau est rouge, contusionnée, sensible ou indurée, ni dans les régions qui présentent des nævi ou des cicatrices.
PREVENIR LE LABORATOIRE D'ANALYSE de la prise de ce traitement avant d'effectuer des analyses biologiques.
Femmes en âge de procréer / Contraception
Les femmes en âge de procréer recevant Hemlibra doivent utiliser une contraception efficace pendant et au moins six mois après l'arrêt du traitement par Hemlibra (voir rubrique Propriétés pharmacocinétiques).
Grossesse
Aucune étude clinique sur l'utilisation d'emicizumab n'a été effectuée chez des femmes enceintes. Aucune étude sur la reproduction n'a été menée chez l'animal avec Hemlibra. Il n'est pas établi si emicizumab peut entraîner des dommages sur le fœtus lorsqu'il est administré à une femme enceinte ou s'il peut affecter la capacité de reproduction. Hemlibra doit être utilisé pendant la grossesse uniquement si le bénéfice potentiel pour la mère l'emporte sur le risque potentiel pour le fœtus. Il conviendra de prendre en compte que le risque de thrombose est accru pendant la grossesse et après l'accouchement et que plusieurs complications de la grossesse sont liées à un risque plus élevé de coagulation intravasculaire disséminée (CIVD).
Allaitement
Il n'a pas été établi que l'emicizumab soit excrété dans le lait maternel. Aucune étude n'a été menée pour évaluer l'impact de l'emicizumab sur la production de lait ou sa présence dans le lait maternel. Il est établi que les IgG humaines sont présentes dans le lait maternel. La décision d'interrompre l'allaitement ou de ne pas initier/d'interrompre le traitement par Hemlibra doit être prise en prenant en compte le bénéfice de l'allaitement pour l'enfant et le bénéfice du traitement pour la mère.
Fertilité
Les études chez l'animal n'indiquent aucun effet nocif direct ou indirect concernant la reprotoxicité (voir rubrique Données de sécurité préclinique). Aucune donnée sur la fertilité n'est disponible chez l'Homme. Par conséquent, les effets d'emicizumab sur la fertilité masculine et féminine sont inconnus.
Aucune étude d'interactions adéquate ou bien contrôlée n'a été réalisée avec emicizumab.
L'expérience clinique indique l'existence d'une interaction médicamenteuse entre emicizumab et l'aPCC (voir rubriques Mises en garde spéciales et précautions d'emploi et Effets indésirables).
Il existe une possibilité d'hypercoagulabilité en cas d'administration de rFVIIa ou de FVIII avec emicizumab, sur la base des expérimentations précliniques. Emicizumab augmente la capacité de coagulation, par conséquent, la dose de rFVIIa ou de FVIII requise pour obtenir l'hémostase peut être inférieure à celle utilisée en l'absence de prophylaxie par Hemlibra.
En cas de complication thrombotique, le médecin doit envisager l'arrêt du rFVIIa ou du FVIII et l'interruption de la prophylaxie par Hemlibra selon le tableau clinique. La prise en charge doit être adaptée aux circonstances cliniques individuelles, en considérant que :
La décision de modification posologique doit tenir compte de la demi-vie d'élimination des médicaments ; en particulier, l'interruption d'emicizumab peut ne pas avoir d'effet immédiat.
La surveillance à l'aide d'un dosage chromogénique du FVIII peut guider l'administration de facteurs de coagulation, et la recherche de marqueurs de thrombophilie peut être envisagée.
Les données sont limitées concernant l'administration concomitante d'anti-fibrinolytiques et d'aPCC ou de rFVIIa chez les patients recevant Hemlibra en prophylaxie. Cependant, la possibilité d'événements thrombotiques doit être considérée lorsque des anti-fibrinolytiques systémiques sont utilisés en association à l'aPCC ou rFVIIa chez des patients traités par emicizumab.
Le traitement doit être instauré sous la surveillance d'un médecin expérimenté dans le traitement de l'hémophilie et/ou des troubles de l'hémostase.
Posologie
Le traitement (incluant la prophylaxie) par des agents by-passants (ex : concentré de facteurs du complexe prothrombique activé [aPCC] et FVII humain recombinant activé [rFVIIa]) doit être interrompu la veille de l'instauration du traitement par Hemlibra (voir rubrique Mises en garde spéciales et précautions d'emploi).
La prophylaxie par facteur VIII (FVIII) peut être poursuivie durant les 7 premiers jours de traitement par Hemlibra.
La posologie recommandée est de 3 mg/kg une fois par semaine au cours des quatre premières semaines (dose de charge), suivie d'une dose d'entretien à partir de la semaine 5, soit de 1,5 mg/kg une fois par semaine, soit de 3 mg/kg toutes les 2 semaines, soit de 6 mg/kg toutes les 4 semaines, toutes les doses étant administrées par injection sous-cutanée.
La dose de charge est la même, quel que soit le schéma posologique choisi pour la dose d'entretien.
Le schéma posologique pour la dose d'entretien doit être choisi en fonction de la préférence du médecin et du patient/aidant afin de favoriser l'observance.
La dose (en mg) et le volume (en mL) doivent être calculés comme suit :
- Dose de charge (3 mg/kg) une fois par semaine pendant les 4 premières semaines : Poids corporel du patient (kg) x dose (3 mg/kg) = quantité totale (mg) d'emicizumab à administrer
- Suivie d'une dose d'entretien à partir de la semaine 5 soit de
1,5 mg/kg une fois par semaine, soit de 3 mg/kg toutes les 2 semaines,
soit de 6 mg/kg toutes les 4 semaines:
- Poids corporel du patient (kg) x dose (1,5 ou 3 ou 6°mg/kg) = quantité totale (mg) d'emicizumab à administrer
Le volume total d'Hemlibra à injecter par voie sous-cutanée est calculé comme suit :
Quantité totale (mg) d'emicizumab à administrer ÷ concentration du flacon (mg/mL) = volume total d'Hemlibra (mL) à injecter.
Des flacons de concentrations différentes d'Hemlibra (30 mg/mL et 150 mg/mL) ne doivent pas être combinés dans la même seringue lors de la préparation du volume total à administrer.
Ne pas administrer un volume supérieur à 2 mL par injection. Exemples :
Patients de poids corporel de 16 kg, à une dose d'entretien de 1,5 mg/kg une fois par semaine :
Exemple de dose de charge (4 premières semaines): 16 kg x 3 mg/kg = 48 mg d'emicizumab nécessaires pour la dose de charge.
Pour calculer le volume à administrer, divisez la dose calculée de 48 mg par 150 mg/mL: 48 mg d'emicizumab ÷ 150 mg/mL = 0,32 mL d'Hemlibra à la concentration de 150 mg/mL à injecter.
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Exemple de dose d'entretien (à partir de la semaine 5): 16 kg x 1,5 mg/kg = 24 mg d'emicizumab nécessaires pour la dose d'entretien.
Pour calculer le volume à administrer, divisez la dose calculée de 24 mg par 30 mg/mL: 24 mg d'emicizumab ÷ 30 mg/mL = 0,8 mL d'Hemlibra à la concentration de 30 mg/mL à injecter une fois par semaine.
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Patients de poids corporel de 40 kg, à une dose d'entretien de 3 mg/kg toutes les deux semaines :
Exemple de dose de charge (4 premières semaines) : 40 kg x 3 mg/kg = 120 mg d'emicizumab nécessaires pour la dose de charge.
Pour calculer le volume à administrer, divisez la dose calculée de 120 mg par 150 mg/mL : 120 mg d'emicizumab ÷ 150 mg/mL = 0,8 mL d'Hemlibra à la concentration de 150 mg/mL à injecter.
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Exemple de dose d'entretien (à partir de la semaine 5) : 40 kg x 3 mg/kg = 120 mg d'emicizumab nécessaires pour la dose d'entretien.
Pour calculer le volume à administrer, divisez la dose calculée de 120 mg par 150 mg/mL : 120 mg d'emicizumab ÷ 150 mg/mL = 0,8 mL d'Hemlibra à la concentration de 150 mg/mL à injecter toutes les deux semaines.
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Patients de poids corporel de 60 kg, à une dose d'entretien de 6 mg/kg toutes les quatre semaines :
Exemple de dose de charge (4 premières semaines) : 60 kg x 3 mg/kg = 180 mg d'emicizumab nécessaires pour la dose de charge.
Pour calculer le volume à administrer, divisez la dose calculée de 180 mg par 150 mg/mL : 180 mg d'emicizumab ÷ 150 mg/mL = 1,20 mL d'Hemlibra à la concentration de 150 mg/mL à injecter.
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Exemple de dose d'entretien (à partir de la semaine 5) : 60 kg x 6 mg/kg = 360 mg d'emicizumab nécessaires pour la dose d'entretien.
Pour calculer le volume à administrer, divisez la dose calculée de 360 mg par 150 mg/mL : 360 mg d'emicizumab ÷ 150 mg/mL = 2,4 mL d'Hemlibra à la concentration de 150 mg/mL à injecter toutes les quatre semaines .
Choisissez le dosage et le volume appropriés à partir des flacons disponibles.
Durée du traitement
Hemlibra est destiné à un traitement prophylactique à long terme.
Ajustements posologiques au cours du traitement
Aucun ajustement posologique n'est recommandé pour Hemlibra.
Oubli ou retard de doses
Si un patient oublie une injection sous-cutanée programmée d'Hemlibra, il doit être indiqué au patient de s'injecter la dose oubliée dès que possible, au plus tard la veille de la dose suivante initialement programmée. Le patient devra s'injecter la dose suivante le jour initialement programmé. Le patient ne doit pas s'injecter deux doses le même jour pour compenser une dose oubliée.
Populations particulières
Population pédiatrique
Aucun ajustement posologique n'est recommandé chez les enfants (voir rubrique Propriétés pharmacocinétiques). Il n'y pas de données disponibles chez les patients de moins de 1 an.
Patients âgés
Aucun ajustement posologique n'est recommandé chez les patients âgés de ≥ 65 ans (voir rubriques Propriétés pharmacodynamiques et Propriétés pharmacocinétiques). Il n'y pas de données disponibles chez les patients de plus de 77 ans.
Insuffisance rénale et hépatique
Aucun ajustement posologique n'est recommandé chez les patients présentant une insuffisance rénale ou hépatique légère (voir rubrique Propriétés pharmacocinétiques). Il existe des données limitées sur l'utilisation d'Hemlibra chez les patients présentant une insuffisance rénale ou hépatique modérée. Emicizumab n'a pas été étudié chez les patients présentant une insuffisance rénale ou hépatique sévère.
Prise en charge dans le cadre périopératoire
La sécurité et l'efficacité d'emicizumab n'ont pas été formellement évaluées lors de chirurgies.
Des patients ont subi une intervention chirurgicale sans interrompre la prophylaxie par emicizumab dans les études cliniques.
Si des agents by-passants (ex : aPCC et rFVIIa) sont nécessaires pendant la période périopératoire, merci de vous référer aux recommandations posologiques relatives à l'utilisation des agents by- passants à la rubrique Mises en garde spéciales et précautions d'emploi.
Si du FVIII est nécessaire pendant la période périopératoire, merci de vous référer à la rubrique Interactions avec d'autres médicaments et autres formes d'interactions.
Pour le suivi biologique de l'activité hémostatique des patients, merci de vous référer à la rubrique Mises en garde spéciales et précautions d'emploi pour les tests de laboratoire non modifiés par emicizumab.
Induction de la tolérance immune (ITI)
La sécurité et l'efficacité d'emicizumab chez les patients recevant une induction de tolérance immune en cours n'ont pas encore été établies. Aucune donnée n'est disponible.
Mode d'administration
Hemlibra doit être uniquement administré par voie sous-cutanée et doit être administré en utilisant une technique aseptique appropriée (voir rubrique Précautions particulières d'élimination et de manipulation).
L'administration doit être limitée aux sites d'injection recommandés : abdomen, parties supérieures externes des bras et cuisses (voir rubrique Propriétés pharmacocinétiques).
L'administration d'Hemlibra par injection sous-cutanée dans la partie supérieure externe du bras doit être réalisée par un aidant ou un professionnel de santé.
Varier le site d'injection peut contribuer à prévenir ou réduire les réactions au site d'injection (voir rubrique Effets indésirables). L'injection sous-cutanée d'Hemlibra ne doit pas être réalisée dans les zones où la peau est rouge, contusionnée, sensible ou indurée, ni dans les régions qui présentent des nævi ou des cicatrices.
Pendant la durée du traitement par Hemlibra, les autres médicaments administrés par voie sous- cutanée doivent de préférence être injectés à des sites anatomiques différents.
Administration par le patient et/ou un aidant
Hemlibra est destiné à être utilisé sous le contrôle d'un professionnel de santé. Après une formation appropriée à la technique d'injection sous-cutanée, un patient pourra s'auto-injecter Hemlibra, ou l'aidant pourra administrer Hemlibra au patient, si le médecin considère que cela est approprié.
Le médecin et l'aidant doivent déterminer si l'auto-administration d'Hemlibra par un enfant est appropriée. Cependant, l'auto-injection n'est pas recommandée pour les enfants âgés de moins de 7 ans.
Pour des instructions complètes sur l'administration d'Hemlibra, veuillez vous reporter à la rubrique Précautions particulières d'élimination et de manipulation et à la notice du médicament.
Durée de conservation :
Flacon non ouvert
2 ans.
Une fois sortis du réfrigérateur, les flacons non ouverts peuvent être conservés à température ambiante (température < 30 °C) pendant une durée maximale de 7 jours.
Après conservation à température ambiante, les flacons non ouverts peuvent être remis au réfrigérateur. Si le flacon est sorti puis remis au réfrigérateur, la durée cumulée totale hors du réfrigérateur ne doit pas dépasser 7 jours. Les flacons ne doivent jamais être exposés à des températures supérieures à 30 °C. Les flacons qui ont été conservés à température ambiante pendant plus de 7 jours ou exposés à des températures supérieures à 30 ° C doivent être jetés.
Flacon percé et seringue remplie
D'un point de vue microbiologique, lorsque le médicament a été transféré du flacon dans la seringue, celui-ci doit être utilisé immédiatement. En cas d'utilisation non immédiate, les durées et conditions de conservation en cours d'utilisation relèvent de la responsabilité de l'utilisateur.
Précautions particulières de conservation :
À conserver au réfrigérateur (entre 2 °C et 8 °C). Ne pas congeler.
Conserver le flacon dans l'emballage extérieur à l'abri de la lumière.
Pour les conditions de conservation du médicament après première ouverture, voir rubrique Durée de conservation.
Aucune incompatibilité n'a été observée entre Hemlibra et les seringues en polypropylène ou polycarbonate et les aiguilles en acier inoxydable.
En l'absence d'études de compatibilité, ce médicament ne doit pas être mélangé avec d'autres médicaments.
Les cas de surdosage avec Hemlibra sont limités.
Symptômes
Un surdosage accidentel peut entraîner une hypercoagulabilité.
Prise en charge
Les patients ayant eu un surdosage accidentel doivent contacter immédiatement leur médecin et faire l'objet d'une surveillance étroite.
Classe pharmacothérapeutique : anti-hémorragiques, autres hémostatiques systémiques, Code ATC : B02BX06
Mécanisme d'action
Emicizumab est un anticorps monoclonal humanisé de type immunoglobuline G4 (IgG4) modifiée ayant une structure bispécifique.
L'emicizumab se lie au facteur IX activé et au facteur X pour restaurer la fonction du FVIIIa manquant, nécessaire pour une hémostase efficace.
L'emicizumab n'a pas de relation structurelle ni d'homologie de séquence avec le FVIII, par conséquent il n'induit pas ni ne favorise le développement d'inhibiteurs dirigés contre le FVIII.
Effets pharmacodynamiques
Le traitement prophylactique par Hemlibra raccourcit le temps de céphaline activée et augmente l'activité rapportée du FVIII (déterminée par un test chromogénique utilisant des facteurs de coagulation d'origine humaine). Ces deux marqueurs pharmacodynamiques ne reflètent pas l'effet hémostatique réel d'emicizumab in vivo (le TCA est très raccourci et l'activité rapportée du FVIII peut être surestimée), mais fournissent une indication relative de l'effet pro-coagulant d'emicizumab.
Efficacité et sécurité cliniques
L'efficacité d'une prophylaxie par Hemlibra chez les patients atteints d'hémophilie A a été évaluée dans cinq études cliniques (trois études chez les adultes et les adolescents atteints d'hémophilie A avec ou sans inhibiteur anti-FVIII [HAVEN 1, HAVEN 3 et HAVEN 4], une étude chez les enfants atteints d'hémophilie A avec inhibiteurs anti-FVIII [HAVEN 2] et une étude chez des patients appartenant à tous les groupes d'âge atteints d'hémophilie A mineure ou modérée sans inhibiteur anti-FVIII [HAVEN 6]).
Études cliniques chez les adultes et les adolescents atteints d'hémophilie A avec ou sans inhibiteuranti-FVIII
Patients (âgés de ≥ 12 ans et > 40 kg) atteints d'hémophilie A sans inhibiteur anti-FVIII (étude BH30071 - HAVEN 3)
L'étude HAVEN 3 était une étude clinique de phase III en ouvert, multicentrique et randomisée, menée chez 152 adultes et adolescents de sexe masculin (âgés de ≥ 12 ans et > 40 kg) atteints d'hémophilie A sévère sans inhibiteur anti-FVIII et ayant déjà reçu un traitement épisodique (« à la demande ») ou prophylactique par FVIII. Les patients ont reçu une injection d'Hemlibra en sous- cutanée, 3 mg/kg une fois par semaine pendant les quatre premières semaines, puis 1,5 mg/kg une fois par semaine (bras A et D) ou 3 mg/kg toutes les deux semaines (bras B), ou aucune prophylaxie (bras C). Les patients du bras C pouvaient passer à Hemlibra (3 mg/kg toutes les deux semaines) après une période d'au moins 24 semaines sans prophylaxie. Pour les bras A et B, une augmentation de la dose jusqu'à 3 mg/kg par semaine a été autorisée après 24 semaines chez les patients qui présentaient au moins deux saignements prédéfinis (c'est-à-dire des saignements spontanés et cliniquement significatifs survenus à l'état d'équilibre). Les patients du bras D pouvaient augmenter leur dose après le second saignement prédéfini. Lors de l'analyse principale, cinq patients ont reçu une augmentation de leur dose d'entretien.
Quatre-vingt-neuf patients ayant déjà reçu du FVIII épisodique (" à la demande ") ont été randomisés selon un ratio de 2:2:1 pour recevoir Hemlibra une fois par semaine (bras A ; N = 36), une fois toutes les deux semaines (bras B ; N = 35) ou sans prophylaxie (bras C ; N = 18), avec une stratification selon le taux de saignement antérieur sur les dernières 24 semaines (< 9 ou ≥ 9). Soixante-trois patients ayant déjà reçu du FVIII en prophylaxie ont été recrutés dans le bras D pour recevoir Hemlibra (1,5 mg/kg une fois par semaine).
L'objectif principal de l'étude était d'évaluer chez des patients ayant déjà reçu du FVIII de façon épisodique, l'efficacité d'une prophylaxie hebdomadaire par Hemlibra (bras A) ou toutes les deux semaines (bras B) comparativement à l'absence de prophylaxie (bras C) en fonction du nombre de saignements nécessitant un traitement par des facteurs de coagulation (voir tableau 4). Les autres objectifs de l'étude comprenaient l'évaluation de la comparaison randomisée des bras A ou B et du bras C pour déterminer l'efficacité d'une prophylaxie par Hemlibra dans la réduction du nombre de saignements de tous types (traités et non traités), de saignements spontanés, de saignements articulaires et de saignements au niveau des articulations cibles (voir tableau 4), ainsi que l'évaluation des préférences des patients en matière de traitement au moyen d'un questionnaire de préférences.
L'efficacité d'une prophylaxie par Hemlibra a également été comparée à celle du traitement prophylactique antérieur par FVIII (bras D) chez des patients qui avaient participé à une étude non- interventionnelle (ENI) avant le recrutement (voir tableau 5). Seuls les patients de l'ENI ont été inclus dans cette comparaison, car les données sur les saignements et le traitement ont été recueillies avec le même degré de granularité que dans l'étude HAVEN 3.
L'ENI est une étude observationnelle dont l'objectif principal est de recueillir des données cliniques détaillées sur les épisodes hémorragiques et l'utilisation de médicaments contre l'hémophilie chez les patients atteints d'hémophilie A en dehors du cadre d'une étude interventionnelle.
Patients (âgés de ≥ 12 ans) atteints d'hémophilie A ayant développé un inhibiteur anti-FVIII (Étude BH29884 - HAVEN 1)
L'étude HAVEN 1 était une étude en ouvert, multicentrique, randomisée, menée chez 109 patients de sexe masculin adolescents et adultes (âgés de ≥ 12 ans) atteints d'hémophilie A, ayant développé un inhibiteur anti-FVIII, et ayant précédemment reçu un traitement épisodique ou prophylactique par des agents by-passants (aPCC et rFVIIa). Dans cette étude, les patients ont reçu une prophylaxie par Hemlibra une fois par semaine (Bras A, C et D) - 3 mg/kg une fois par semaine pendant quatre semaines, suivie par 1,5 mg/kg une fois par semaine- ou aucune prophylaxie (Bras B). Les patients randomisés dans le bras B pouvaient passer à une prophylaxie par Hemlibra après une période d'au moins 24 semaines sans prophylaxie. Une augmentation de la posologie jusqu'à 3 mg/kg une fois par semaine était autorisée après 24 semaines de prophylaxie par Hemlibra pour les patients qui présentaient au moins deux saignements prédéfinis (c'est-à-dire des saignements spontanés et vérifiés cliniquement significatifs survenant à l'état d'équilibre). Au moment de l'analyse primaire, deux patients ont bénéficié d'une augmentation posologique de leur dose d'entretien jusqu'à 3 mg/kg une fois par semaine.
Cinquante-trois patients précédemment traités de façon épisodique (« à la demande ») par des agents by-passants ont été randomisés selon un rapport de 2:1 pour recevoir une prophylaxie par Hemlibra (Bras A) ou aucune prophylaxie (Bras B), avec une stratification selon le taux de saignements (< 9 ou ≥ 9) au cours des 24 semaines précédentes.
Quarante-neuf patients ayant précédemment reçu un traitement prophylactique par des agents by- passants ont été inclus dans le Bras C afin de recevoir une prophylaxie par Hemlibra. Sept patients précédemment traités de façon épisodique (« à la demande ») par des agents by-passants, ayant participé à l'ENI avant l'inclusion, mais n'ayant pas été en mesure de participer à l'étude HAVEN 1 avant la clôture des Bras A et B, ont été inclus dans le Bras D afin de recevoir une prophylaxie par Hemlibra.
L'objectif principal de l'étude a été d'évaluer, chez les patients précédemment traités de façon épisodique (« à la demande ») par des agents by-passants, l'effet d'une prophylaxie hebdomadaire par Hemlibra, par rapport à une absence de prophylaxie (Bras A vs Bras B) sur le nombre de saignements nécessitant un traitement par des facteurs de coagulation sur une période de temps donné (au minimum 24 semaines ou jusqu'à la date d'interruption) (voir tableau 6). Les objectifs secondaires de la comparaison randomisée des Bras A et B ont été l'efficacité de la prophylaxie hebdomadaire par Hemlibra sur la réduction du nombre de saignements de tous types (traités et non traités), de saignements spontanés, de saignements articulaires et de saignements au niveau des articulations cibles (voir tableau 6), ainsi que l'évaluation de la qualité de vie liée à la santé (QdV) et de l'état de santé des patients (voir tableaux 10 et11). Le temps moyen d'exposition (+ écart type) pour tous les patients étudiés était de 21,38 semaines (12,01). Pour chaque bras de traitement, les temps d'exposition moyens (+ET) étaient de 28,86 semaines (8,37) pour le bras A, 8,79 semaines (3,62) pour le bras B, 21,56 semaines (11,85) pour le bras C et 7,08 semaines (3,89) pour le bras D. Un patient du bras A est sorti de l'étude avant l'initiation d'Hemlibra.
L'étude a également évalué l'efficacité de la prophylaxie hebdomadaire par Hemlibra par rapport à un traitement antérieur épisodique (« à la demande ») ou prophylactique par des agents by-passants (comparaisons séparées) chez des patients ayant participé à l'étude non interventionnelle avant l'inclusion (respectivement Bras A et C) (voir tableau 7).
Patients (âgés de ≥ 12 ans) atteints d'hémophilie A avec ou sans inhibiteur anti-FVIII (étude BO39182
- HAVEN 4)
Hemlibra a fait l'objet d'une étude clinique de phase III multicentrique, à un seul bras, menée chez 41 adultes et adolescents de sexe masculin (âgés de ≥ 12 ans et > 40 kg) atteints d'hémophilie A avec inhibiteurs anti-FVIII ou d'hémophilie A sévère sans inhibiteur anti-FVIII et ayant déjà reçu un traitement épisodique (" à la demande ") ou prophylactique par agent by-passants ou FVIII. Les patients ont reçu une prophylaxie par Hemlibra - 3 mg/kg une fois par semaine pendant quatre semaines, suivie par 6 mg/kg toutes les quatre semaines.
L'objectif principal de l'étude était d'évaluer l'efficacité d'une prophylaxie par Hemlibra administrée toutes les quatre semaines sur le maintien du contrôle des saignements, mesuré par les saignements traités. D'autres objectifs évaluaient l'efficacité clinique d'une prophylaxie par Hemlibra sur des saignements de tous types (traités et non traités), de saignements spontanés traités, de saignements articulaires traités et de saignements articulaires cibles traités (voir tableau 8). La préférence de traitement des patients a également été évaluée à l'aide d'un questionnaire dédié.
Patients (tous âges) atteints d'hémophilie A mineure ou modérée sans inhibiteur anti-FVIII (étude BO41423 - HAVEN 6)
L'étude HAVEN 6 était une étude clinique de phase III en ouvert, multicentrique, mono-bras, menée chez 71 patients traités par emicizumab (tous âges) atteints d'hémophilie A mineure (n = 20 [28,2 %]) ou modérée (n = 51 [71,8 %]) sans inhibiteur anti-FVIII pour laquelle une prophylaxie était indiquée, selon l'évaluation de l'investigateur. La majorité des patients étaient de sexe masculin (69 patients [97,2 %]) et 2 étaient de sexe féminin (2,8 %). À l'inclusion dans l'étude, 34 patients (47,9 %) recevaient un traitement épisodique (« à la demande ») et 37 patients (52,1 %) un traitement prophylactique par FVIII. Les patients ont reçu une injection d'Hemlibra en sous-cutané, 3 mg/kg une fois par semaine pendant les quatre premières semaines, puis le schéma posologique d'entretien selon leur préférence parmi les schémas suivants, à partir de la semaine 5 : 1,5 mg/kg une fois par semaine (n = 24 [33,8 %]), 3 mg/kg toutes les deux semaines (n = 39 [54,9 %]) ou 6 mg/kg toutes les quatre semaines (n = 8 [11,3 %]). Une augmentation de la dose jusqu'à 3 mg/kg par semaine a été autorisée après 24 semaines chez les patients qui présentaient au moins deux saignements prédéfinis (c'est-à- dire des saignements spontanés et cliniquement significatifs survenus à l'état d'équilibre). Lors de l'analyse intermédiaire, aucun patient n'a reçu une augmentation de sa dose d'entretien.
L'objectif principal d'efficacité de l'étude était d'évaluer l'efficacité d'une prophylaxie par Hemlibra en fonction du nombre de saignements nécessitant un traitement par facteurs de coagulation au cours du temps (c'est-à-dire le taux de saignements traités, voir tableau 9). Les autres objectifs étaient d'évaluer l'efficacité d'une prophylaxie par Hemlibra en fonction du nombre de saignements de tous types (traités et non traités), de saignements spontanés, de saignements articulaires et de saignements au niveau des articulations cibles au cours du temps, ainsi que d'évaluer la qualité de vie liée à la santé (QdV) rapportée par les patients au moyen du questionnaire Comprehensive Assessment Tool of Challenges in Haemophilia (CATCH) au cours du temps.
Résultats d'efficacité
Etude HAVEN 3
Les résultats d'efficacité d'une prophylaxie par Hemlibra comparés à l'absence de prophylaxie sur le taux de saignements traités, de saignements de tous types (traités et non traités), de saignements spontanés traités, de saignements articulaires traités et de saignements au niveau des articulations cibles traités sont présentés dans le tableau 4.
Tableau 4 Étude HAVEN 3 : Taux de saignement annualisé pour le bras Hemlibra en prophylaxie versus le bras sans prophylaxie chez les patients ≥ 12 ans sans inhibiteur anti-FVIII
| Critères d'évaluation | Bras C: Sans prophylaxie (N = 18) | Bras A: Hemlibra 1,5 mg/kghebdomadaire (N = 36) | Bras B: Hemlibra 3 mg/kgtoutes les 2 semaines (N = 35) |
| Saignements traités | |||
| ABR (IC à 95 %) | 38,2 (22,9 ; 63,8) | 1,5 (0,9 ; 2,5) | 1,3 (0,8 ; 2,3) |
| % de réduction (RR), valeur de p | NA | 96 % (0,04),< 0,0001 | 97 % (0,03),< 0,0001 |
| % de patients aveczéro saignement (IC à 95 %) | 0,0 (0,0 ; 18,5) | 55,6 (38,1 ; 72,1) | 60,0 (42,1; 76,1) |
| ABR médian (EQ) | 40,4 (25,3 ; 56,7) | 0 (0 ; 2,5) | 0 (0 ; 1,9) |
| Tous types de saignements | |||
| ABR (IC à 95 %) | 47,6 (28,5 ; 79,6) | 2,5 (1,6 ; 3,9) | 2,6 (1,6 ; 4,3) |
| % de réduction (RR), valeur | NA | 95 % (0,05), | 94 % (0,06), |
| de p | <0,0001 | <0,0001 | |
| % de patients aveczéro saignement (IC à 95 %) | 0 (0,0 :18,5) | 50 (32,9 ; 67,1) | 40 (23,9 ; 57,9) |
| Saignements spontanés traités | |||
| ABR (IC à 95 %) | 15,6 (7,6 ; 31,9) | 1,0 (0,5 ; 1,9) | 0,3 (0,1 ; 0,8) |
| % de réduction (RR), valeur | NA | 94 % (0,06), | 98 % (0,02), |
| de p | <0,0001 | <0,0001 | |
| % de patients aveczéro saignement (IC à 95 %) | 22,2 (6,4 ; 47,6) | 66,7 (49,0 ; 81,4) | 88,6 (73,3 ; 96,8) |
| Saignements articulaires traités | |||
| ABR (IC à 95 %) | 26,5 (14,67 ; 47,79) | 1,1 (0,59 ; 1,89) | 0,9 (0,44 ; 1,67) |
| % de réduction (RR), valeur | NA | 96 % (0,04), | 97 % (0,03), |
| de p | <0,0001 | <0,0001 | |
| % de patients aveczéro saignement (IC à 95 %) | 0 (0 ; 18,5) | 58,3 (40,8 ; 74,5) | 74,3 (56,7 ; 87,5) |
| Critères d'évaluation | Bras C: Sans prophylaxie (N = 18) | Bras A: Hemlibra 1,5 mg/kghebdomadaire (N = 36) | Bras B: Hemlibra 3 mg/kgtoutes les 2 semaines (N = 35) |
| Saignements au niveau des articulations cibles traités | |||
| ABR (IC à 95 %) | 13,0 (5,2 ; 32,3) | 0,6 (0,3 ; 1,4) | 0,7 (0,3 ; 1,6) |
| % de réduction (RR), valeur | NA | 95 % (0,05), | 95 % (0,05), |
| de p | <0,0001 | <0,0001 | |
| % de patients avec zéro saignement (IC à 95 %) | 27,8 (9,7 ; 53,5) | 69,4 (51,9 ; 83,7) | 77,1 (59,9 ; 89,6) |
| Le rapport des taux et l'intervalle de confiance (IC) provenant d'un modèle de régression binomiale négative (RBN) et la valeur de p sont calculés à l'aide d'un test de Wald stratifié, comparant le taux de saignement annualisé (ABR) entre les bras spécifiés. Bras C : patients n'ayant pas reçu de prophylaxie.Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). Saignements traités : saignements traités par FVIII. Tous types de saignements : saignements traités et non traités par FVIII. Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Patients exposés à l'emicizumab en commençant par la dose de charge de 3 mg/kg/semaine pendant 4 semaines .ABR : Taux de saignements annualisé ; IC : intervalle de confiance ; RR : rapport des taux ; EQ : écart interquartile, 25e percentile au 75e percentile. NA : Non Applicable | |||
Dans l'analyse intra-patient de l'étude clinique HAVEN 3, la prophylaxie par Hemlibra a permis une réduction statistiquement significative du taux de saignements traités (68 %, p < 0,0001), par rapport à une prophylaxie antérieure par FVIII recueillie dans l'ENI avant le recrutement (voir tableau 5).
Tableau 5 Etude HAVEN 3 : Comparaison intra-patient du taux de saignement annualisé (saignements traités) avec une prophylaxie par Hemlibra versus une prophylaxie antérieure par FVIII
| Critères d'évaluation | Bras D ENI : Prophylaxie antérieure par FVIII (N = 48) | Bras D : Hemlibra 1,5 mg/kg 1 fois par semaine (N = 48) |
| Période d'efficacité médiane(semaines) | 30,1 | 33,7 |
| Saignements traités | ||
| ABR (IC à 95 %) | 4,8 (3,2 ; 7,1) | 1,5 (1 ; 2,3) |
| % de réduction (RR), valeur dep | 68 % (0,32), <0,0001 | |
| % de patients avec zérosaignement (IC à 95 %) | 39,6 (25,8 ; 54,7) | 54,2 (39,2 ; 68,6) |
| ABR médian (EQ) | 1,8 (0 ; 7,6) | 0 (0 ; 2,1) |
| Le
rapport des taux et l'intervalle de confiance (IC) provenant d'un
modèle de régression binomiale négative (RBN) et la valeur de p sont
calculés à l'aide d'un test de Wald stratifié, comparant le taux de
saignement annualisé (ABR) entre les bras spécifiés. Données de comparaison intra-patient provenant de l'étude non-interventionnelle (ENI). Seuls les patients ayant participé à l'ENI et à l'étude HAVEN 3 ont été inclus. Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Saignements traités : saignements traités par FVIII.Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). ABR : Taux de saignement annualisé ; IC : intervalle de confiance ; RR : rapport des taux ; EQ : écart interquartile, 25e percentile au 75e percentile. Bien qu'une meilleure adhérence au traitement prophylactique par emicizumab ait été observée par rapport à la prophylaxie antérieure par FVIII, aucune différence sur les taux de saignements annualisés n'a pu être identifiée pour les patients ayant été observants à ≥ 80% ou <80% de leur dose prophylactique de FVIII selon les libellés d'AMM (les données doivent être interprétées avec prudence compte tenu des petites tailles d'échantillons). En raison de la courte demi-vie du FVIII, aucun effet résiduel n'est attendu après son interruption. Seules les cinq premières doses d'emicizumab ont dû être administrées sous surveillance pour garantir la sécurité et la maîtrise de la technique d'injection. Comme pour la prophylaxie par FVIII, l'auto- administration à domicile était autorisée pour toutes les doses suivantes d'emicizumab. Tous les patients ont été traités par des experts en hémophilie, qui ont confirmé qu'une prophylaxie adéquate par FVIII avait été administrée aux patients inclus dans la comparaison intra-patient, ce qui justifiait une prise en charge par prophylaxie habituelle équivalente entre les centres et les patients. | ||
Etude HAVEN 1
Les résultats d'efficacité d'une prophylaxie par Hemlibra comparés à l'absence de prophylaxie sur le taux de saignements traités, de saignements de tous types (traités et non traités), de saignements spontanés traités, de saignements articulaires traités et de saignements au niveau des articulations cibles traités sont présentés dans le tableau 6.
Tableau 6 Etude HAVEN 1 : Taux de saignement annualisé avec le bras Hemlibra en prophylaxie versus le bras sans prophylaxie chez les patients ≥ 12 ans avec inhibiteurs anti-FVIII
| Critères d'évaluation | Bras B : pas de prophylaxie | Bras A : 1,5 mg/kg d'Hemlibra par semaine |
| N = 18 | N = 35 | |
| Saignements traités | ||
| ABR (IC à 95 %) | 23,3 (12,33 ; 43,89) | 2,9 (1,69 ; 5,02) |
| % de réduction (RR), valeur de p | 87 % (0,13), < 0,0001 | |
| % de patients avec zéro saignement (IC à 95 %) | 5,6 (0,1 ; 27,3) | 62,9 (44,9 ; 78,5) |
| ABR médian (EQ) | 18,8 (12,97 ; 35,08) | 0 (0 ; 3,73) |
| Tous types de saignements | ||
| ABR (IC à 95 %) | 28,3 (16,79 ; 47,76) | 5,5 (3,58 ; 8,60) |
| % de réduction (RR), valeur de p | 80 % (0,20), < 0,0001 | |
| % de patients avec zéro saignement (IC à 95 %) | 5,6 (0,1 ; 27,3) | 37,1 (21,5 ; 55,1) |
| Saignements spontanés traités | ||
| ABR (IC à 95 %) | 16,8 (9,94 ; 28,30) | 1,3 (0,73 ; 2,19) |
| % de réduction (RR), valeur de p | 92 % (0,08), < 0,0001 | |
| % de patients avec zéro saignement (IC à 95 %) | 11,1 (1,4 ; 34,7) | 68,6 (50,7 ; 83,1) |
| Saignements articulaires traités | ||
| ABR (IC à 95 %) | 6,7 (1,99 ; 22,42) | 0,8 (0,26 ; 2,20) |
| % de réduction (RR), valeur de p | 89 % (0,11) ; 0,0050 | |
| % de patients avec zéro saignement (IC à 95 %) | 50,0 (26,0 ; 74,0) | 85,7 (69,7 ; 95,2) |
| Saignements au niveau des articulations cibles traités | ||
| ABR (IC à 95 %) | 3,0 (0,96 ; 9,13) | 0,1 (0,03 ; 0,58) |
| % de réduction (RR), valeur de p | 95 % (0,05) ; 0,0002 | |
| % de patients avec zéro saignement (IC à 95 %) | 50,0 (26,0 ; 74,0) | 94,3 (80,8 ; 99,3) |
| Le rapport des taux et l'intervalle de confiance (IC) provenant d'un modèle de régression binomiale négative (RBN) et la valeur de p sont calculés à l'aide d'un test de Wald stratifié, comparant le taux de saignement annualisé (ABR) entre les bras spécifiés.Bras B : patients n'ayant pas reçu de prophylaxie.Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis).Saignements traités = saignements traités par des agents by-passants.Tous types de saignements = saignements traités et non traités par des agents by-passants.Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Patients exposés à l'emicizumab en commençant par la dose de charge de 3 mg/kg/semaine pendant 4 semaines.ABR = Taux de saignements annualisé ; IC = intervalle de confiance ; RR = rapport des taux ; EQ = écart interquartile, 25e percentile au 75e percentile. | ||
Au cours de l'analyse intra-patient HAVEN 1, la prophylaxie par Hemlibra a entraîné une réduction statistiquement (p = 0,0003) et cliniquement significative (79 %) du taux de saignements pour les saignements traités, par rapport aux résultats observés avec la précédente prophylaxie par des agents by-passants au cours de l'étude non interventionnelle précédant l'inclusion (voir Tableau 7).
Tableau 7 Etude HAVEN 1 : Comparaison intra-patient du taux de saignement annualisé (saignements traités) avec une prophylaxie par Hemlibra versus une prophylaxie antérieure par agent by-passant (ENI)
| Critère d'évaluation | Bras CENI : prophylaxie antérieure par agent by-passant | Bras C : Hemlibra 1,5 mg/kg par semaine |
| N = 24 | N = 24 | |
| Saignements traités | ||
| ABR (IC à 95 %) | 15,7 (11,08 ; 22,29) | 3,3 (1,33 ; 8,08) |
| % de patients avec zéro saignement (IC à 95 %) | 12,5 (2,7 ; 32,4) | 70,8 (48,9 ; 87,4) |
| ABR median (EQ) | 12,0 (5,73 ; 24,22) | 0,0 (0,00 ; 2,23) |
| % de réduction(RR), valeur de p | 79 %(0,21) ; 0,0003 | |
| Le
rapport des taux et l'intervalle de confiance (IC) provenant d'un
modèle de régression binomiale négative (RBN) et la valeur de p sont
calculés à l'aide d'un test de Wald stratifié, comparant le taux de
saignement annualisé (ABR) entre les bras spécifiés. Données de comparaison intra-patient provenant de l'étude non-interventionnelle (ENI). Seuls les patients ayant participé à l'ENI et à l'étude HAVEN 1 ont été inclus. Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Saignements traités : saignements traités par des agents by-passants. Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). ABR= Taux de saignement annualisé ; IC= intervalle de confiance ; RR= rapport des taux ; EQ = écart interquartile, 25e percentile au 75e percentile. Bien qu'une meilleure adhérence au traitement prophylactique par emicizumab ait été observée par rapport à la prophylaxie antérieure par agents by-passants, aucune différence sur les taux de saignements annualisés n'a pu être identifiée pour les patients ayant été observants à ≥ 80% ou <80% de leur dose prophylactique d'agents by-passants selon les libellés d'AMM (les données doivent être interprétées avec prudence compte tenu des petites tailles d'échantillons). En raison de la courte demi-vie des agents by-passants, aucun effet résiduel n'est attendu après leur interruption. Seules les cinq premières doses d'emicizumab ont dû être administrées sous surveillance pour garantir la sécurité et la maîtrise de la technique d'injection. Comme pour la prophylaxie par agents by-passants, l'auto-administration à domicile était autorisée pour toutes les doses suivantes d'emicizumab. | ||
Etude HAVEN 4
Les résultats de l'analyse primaire d'efficacité d'une prophylaxie par Hemlibra toutes les quatre semaines sur le taux de saignements traités, de saignements de tous types (traités et non traités), de saignements spontanés traités, de saignements articulaires traités et de saignements au niveau des articulations cibles traités sont présentés dans le tableau 8. L'efficacité a été évaluée chez quarante-et- un patients âgés de ≥ 12 ans avec un temps d'observation médian de 25,6 semaines (intervalle : 24,1 - 29,4).
Table 8 Etude HAVEN 4 : Taux de saignement annualisé sous Hemlibra en prophylaxie chez les patients âgés de ≥ 12 ans avec ou sans inhibiteur anti-FVIII
| Hemlibra 6mg/kg toutes les 4 semaines | |||
| Critères d'évaluation | aABR (IC à 95 %) | bABR median (EQ) | % de patients avec zéro saignement (IC à 95 %) |
| N | 41 | 41 | 41 |
| Saignements traités | 2,4 (1,4 ; 4,3) | 0,0 (0,0 ; 2,1) | 56,1 (39,7 ; 71,5) |
| Tous types desaignements | 4,5 (3,1 ; 6,6) | 2,1 (0,0 ; 5,9) | 29,3 (16,1 ; 45,5) |
| Saignements spontanéstraités | 0,6 (0,3 ;1,5) | 0,0 (0,0 ; 0,0) | 82,9 (67,9 ; 92,8) |
| Saignementsarticulaires traités | 1,7 (0,8 ; 3,7) | 0,0 (0,0 ; 1,9) | 70,7 (54,5 ; 83,9) |
| Saignements au niveau des articulations ciblestraités | 1,0 (0,3 ; 3,3) | 0,0 (0,0 ; 0,0) | 85,4 (70,8 ; 94,4) |
| a Calculé avec un modèle de régression binomiale négative (RBN) b ABR calculéLes définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). Saignements traités : saignements traités par FVIII ou rFVIIa Tous types de saignements : saignements traités et non traités par le FVIII ou le rFVIIa. Les patients exposés à emicizumab ont commencé par la dose de charge de 3 mg/kg/semaine pendant 4 semaines. ABR : taux de saignement annualisé, IC : intervalle de confiance ; EQ : intervalle interquartile, 25e percentile au 75e percentile. | |||
Etude HAVEN 6 (analyse intermédiaire)
L'efficacité a été évaluée chez cinquante et un patients atteints d'hémophilie A modérée âgés de 2 à 56 ans avec un temps d'observation médian de 30,4 semaines (intervalle : 17,4 - 61,7).
Les résultats de l'analyse intermédiaire d'efficacité d'une prophylaxie par Hemlibra chez les patients ayant une hémophilie A modérée (voir rubrique Indications thérapeutiques) sur le taux de saignements traités, de saignements de tous types (traités et non traités), de saignements spontanés traités, de saignements articulaires traités et de saignements au niveau des articulations cibles traités sont présentés dans le tableau 9.
Tableau 9 HAVEN 6 : Taux de saignement annualisé sous Hemlibra en prophylaxie chez les patients atteints d'hémophilie A modérée sans inhibiteur anti-FVIII
| cHemlibra 1,5 mg/kg une fois par semaine, 3 mg/kg toutes les 2 semaines ou 6 mg/kg toutes les 4 semaines | |||
| Critères d'évaluation | aABR (IC à 95 %) | bABR médian (EQ) | % de patients avec zéro saignement (IC à 95 %) |
| N | 51 | 51 | 51 |
| Saignements traités | 0,9 [0,43 ; 1,89] | 0,0 [0,00 ; 0,00] | 78,4 [64,7 ; 88,7] |
| Saignements de toustypes | 2,6 [1,81 ; 3,81] | 1,7 [0,00 ; 3,90] | 43,1 [29,3 ; 57,8] |
| Saignements spontanéstraités | 0,1 [0,03 ; 0,30] | 0,0 [0,00 ; 0,00] | 94,1 [83,8 ; 98,8] |
| Saignementsarticulaires traités | 0,3 [0,10 ; 0,84] | 0,0 [0,00 ; 0,00] | 90,2 [78,6 ; 96,7] |
| Saignements au niveau des articulations ciblestraités | 0,1 [0,02 ; 0,26] | 0,0 [0,00 ; 0,00] | 96,1 [86,5 ; 99,5] |
| a Calculé avec un modèle de régression binomiale négative (RBN) b ABR calculé Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). Saignements traités : saignements traités par FVIII.Saignements de tous types : saignements traités et non traités par FVIII. Les patients exposés à emicizumab ont commencé par la dose de charge de 3 mg/kg/semaine pendant 4 semaines. ABR : taux de saignement annualisé ; IC : intervalle de confiance ; EQ : écart interquartile ; 25e percentile au 75e percentilec 1,5 mg/kg une fois par semaine (n = 16) ; 3 mg/kg toutes les 2 semaines (n = 30) ; 6 mg/kg toutes les 4 semaines (n = 5). | |||
Mesures des résultats liés à l'état de santé
Les études cliniques HAVEN ont évalué la qualité de vie liée à la santé (QdV) et l'état de santé à l'aide de mesures d'évaluation des résultats cliniques. HAVEN 1 et 2 ont utilisé le questionnaire sur la qualité de vie spécifique à l'hémophilie (Haem-A-QoL) respectivement pour les adultes (> 18 ans) et pour les adolescents (Haem-A-QoL-SF, de 8 à < 18 ans), pour lequel le score de santé physique (c'est- à-dire gonflements douloureux, présence de douleurs articulaires, douleur au mouvement, difficulté à marcher loin et besoin de plus de temps pour se préparer) et le score total (résumé de tous les scores) étaient des paramètres d'intérêt définis dans le protocole. HAVEN 2 a également utilisé le questionnaire Adapted InhibQoL with Aspects of Caregiver Burden rempli par les aidants pour obtenir une évaluation de la QdV chez les enfants âgés de moins de 12 ans. HAVEN 6 a évalué la QdV chez les adultes et les enfants, ainsi que chez les aidants des enfants, à l'aide du questionnaire Comprehensive Assessment Tool of Challenges in Haemophilia (CATCH). Les sections relatives à la perception des risques et de l'impact de l'hémophilie sur les activités quotidiennes, les activités sociales, les activités de loisirs et les activités professionnelles/scolaires, ainsi que de la préoccupation et du poids du traitement ont été examinés. Pour mesurer l'évolution de l'état de santé, l'Index Utility score (IUS) et l'Echelle Visuelle Analogique (EVA) du questionnaire EuroQoL à cinq dimensions et cinq niveaux (EQ-5D-5L) ont été examinés.
Etude HAVEN 1 résultats liés à l'état de santé
Dans cette étude, à l'inclusion, les scores totaux (moyenne = 41,14 et 44,58, respectivement) et les scores d'échelle de santé physique (moyenne = 52,41 et 57,19, respectivement) étaient similaires pour les bras prophylaxie d'Hemlibra et sans prophylaxie. Le tableau 10 présente un résumé de la comparaison entre le bras prophylaxie d'Hemlibra (bras A) et le bras sans prophylaxie (bras B) sur l'échelle du score total Haem-A-QoL et sur l'échelle de santé physique après 24 semaines de traitement (résultats ajustés en tenant compte de la valeur à l'inclusion). La prophylaxie hebdomadaire par Hemlibra a montré une amélioration statistiquement et cliniquement significative par rapport au bras sans prophylaxie pour les critères d'évaluation pré-spécifiés suivants : score de l'Échelle de santé physique (Physical Health Scale) du questionnaire Haem-A-QoL lors de l'évaluation à la semaine 25.
Tableau 10 Etude HAVEN 1 : Modification des scores de santé physique et total du Haem-A- QoL en prophylaxie par Hemlibra versus pas de prophylaxie chez les patients âgés de ≥ 18 ans avec inhibiteurs anti-FVIII
| Haem-A-QoL à la semaine 25 | Bras B : pas de prophylaxie (N = 14) | Bras A : Hemlibra 1,5 mg/kg 1 fois par semaine (N = 25) |
| Score de santé physique (intervalle de 0 à 100) | ||
| Moyenne ajustée | 54,17 | 32,61 |
| Différence des moyennes ajustées (IC à 95 %) | 21,55 (7,89 ; 35,22) | |
| Valeur p | 0,0029 | |
| Score total (intervalle de 0 à 100) | ||
| Moyenne ajustée | 43,21 | 29,2 |
| Différence des moyennes ajustées (IC à 95 %) | 14,01 (5,56 ; 22,45) | |
| Bras B : il n'inclut que des patients n'ayant pas reçu de prophylaxie. Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Les patients exposés à l'emicizumab ont commencé par la dose de charge de 3 mg/kg/semaine pendant 4 semaines. Les échelles de Haem-A-QoL vont de 0 à 100. Les scores inférieurs reflètent une meilleure QdV. Différence cliniquement significative : Score total : 7 points ; Santé physique : 10 points. Les analyses sont basées sur des données provenant d'individus ayant fourni des réponses à l'évaluation initiale et à la semaine 25. | ||
Etude HAVEN 1 Résultats liés à l'état de santé
Le tableau 11 présente un résumé de la comparaison entre le bras prophylaxie Hemlibra (bras A) et le bras sans prophylaxie (bras B) sur l'index d'utilité du questionnaire EQ-5D-5L et sur l'échelle visuelle analogique [EVA] après 24 semaines de traitement (résultats ajustés en tenant compte de la valeur à l'inclusion).
Tableau 11 Etude HAVEN 1 : Scores EQ-5D-5L chez les patients âgés de ≥ 12 ans à la semaine 25
| Scores EQ-5D-5L après 24 semaines | Bras B : pas de prophylaxie (N = 16) | Bras A : Hemlibra1,5 mg/kg par semaine (N= 29) |
| Échelle visuelle analogique | ||
| Moyenne ajustée | 74,36 | 84,08 |
| Différence des moyennes ajustées (IC à 95 %) | -9,72 (-17,62 ; -1,82) | |
| Index d'utilité | ||
| Moyenne ajustée | 0,65 | 0,81 |
| Différence des moyennes ajustées (IC à 95 %) | -0,16 (-0,25 ; -0,07) | |
| Bras B : il n'inclut que des patients n'ayant pas reçu de prophylaxie. Pour les patients dont la posologie a été augmentée, seules les données précédant cette augmentation ont été incluses. Les patients exposés à l'emicizumab ont commencé par la dose de charge de 3 mg/kg/semaine pendant 4 semaines. Des scores plus élevés indiquent une meilleure qualité de vie. Différence cliniquement significative : EVA : 7 points ; index d'utilité : 0,07 point. Les analyses sont basées sur des données provenant d'individus ayant fourni des réponses à l'évaluation initiale et à la semaine 25. | ||
Etude HAVEN 6 Résultats liés à l'état de santé
Dans l'étude HAVEN 6, la Qualité de Vie liée à la santé (QdV) chez les patients de tous âges atteints d'hémophilie A modérée a été évaluée à la semaine 25 sur la base du questionnaire CATCH. Le questionnaire CATCH (version 1.0) est un instrument validé qui évalue l'effet de l'hémophilie et de son traitement. Il existe plusieurs versions du questionnaire, pour les adultes, pour les enfants et pour les aidants des enfants. La qualité de vie liée à la santé chez les patients recevant une prophylaxie par Hemlibra est restée globalement stable, avec une amélioration systématique des items relatifs au poids du traitement dans le questionnaire CATCH parmi les différentes catégories de répondeurs.
Population pédiatrique
Enfants (âgés de < 12 ans, ou âgés de 12 à 17 ans et pesant moins de 40 kg) atteints d'hémophilie A ayant développé un inhibiteur anti-FVIII (Étude BH29992 - HAVEN 2)
Une prophylaxie hebdomadaire par Hemlibra a été évaluée dans une étude clinique ouverte, multicentrique mono-bras, en pédiatrie, menée chez les patients âgés de < 12 ans, ou de 12 à 17 ans et pesant moins de 40 kg atteints d'hémophilie A, ayant développé un inhibiteur anti-FVIII. Les patients ont reçu une prophylaxie par Hemlibra à une dose de 3 mg/kg une fois par semaine pendant les 4 premières semaines, suivi de 1,5 mg/kg une fois par semaine.
L'étude a évalué les propriétés pharmacocinétiques (PK), la sécurité et l'efficacité, notamment l'efficacité de la prophylaxie hebdomadaire par Hemlibra par rapport aux précédents traitements à visée curative ou prophylactique par un agent by-passant, chez les patients ayant participé à l'étude non-interventionnelle avant l'inclusion (comparaison intra-patient).
Résultats d'efficacité
Etude HAVEN 2 (analyse intermédiaire)
Au moment de l'analyse intermédiaire, l'efficacité a été évaluée chez 59 patients âgés de < 12 ans et recevant une prophylaxie par Hemlibra hebdomadaire depuis au moins 12 semaines, dont quatre patients âgés de moins de 2 ans, 17 patients âgés de 2 à < 6 ans et 38 patients âgés de 6 à < 12 ans. Le taux de saignement annualisé et le pourcentage de patients sans saignement ont été calculés (voir tableau 12). La durée d'observation médiane pour ces patients était de 29,6 semaines (intervalle : 18,4 à 63,0 semaines).
Tableau 12 Etude HAVEN 2 : Résumé des données de l'efficacité (analyse intermédiaire)
| Critère d'efficacité | aABR (IC à 95 %)b N = 59 | cABR médian (EQ)b N = 59 | % Zéro saignement (IC à 95 %)b N = 59 |
| Saignements traités | 0,3 (0,1 ; 0,5) | 0 (0 ; 0) | 86,4 (75 ; 94) |
| Tous types de saignements | 3,8 (2,2 ; 6,5) | 0 (0 ; 3.4) | 55,9 (42,4 ; 68,8) |
| Saignements spontanés traités | 0 (0 ; 0,2) | 0 (0 ; 0) | 98,3 (90,9 ; 100) |
| Saignements articulaires traités | 0,2 (0,1 ; 0,4) | 0 (0 ; 0) | 89,8 (79,2 ; 96,2) |
| Saignements au niveau des articulations cibles traités | 0,1 (0 ; 0,7) | 0 (0 ; 0) | 96,6 (88,3 ; 99,6) |
| ABR : Taux de saignements annualisé ; IC : intervalle de confiance ; EQ : écart interquartile, 25e percentile au 75e percentile a Calculé avec un modèle de régression binomiale négative (RBN). b Données d'efficacité des patients âgés de < 12 ans et ayant participé à l'étude HAVEN 2 pendant au moins 12 semaines (N= 59), car l'étude visait principalement à étudier l'effet du traitement en fonction de l'âge. c ABR calculé Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). Saignements traités : saignements traités par des agents by-passants. Tous types de saignements : saignements traités et non traités par des agents by-passants. Les patients exposés à l'emicizumab ont commencé avec la dose de charge de 3 mg/kg/semaine pendant 4 semaines. | |||
Dans l'analyse intra-patient, la prophylaxie hebdomadaire par Hemlibra a entraîné une réduction cliniquement significative (98 %) des saignements traités chez 18 patients pédiatriques après au moins 12 semaines de prophylaxie par Hemlibra, par rapport à leur taux de saignements recueilli au cours de l'étude non-interventionnelle avant l'inclusion (tableau 13).
Tableau 13 Etude HAVEN 2 : Comparaison intra-patient du taux de saignement annualisé (saignements traités) avec une prophylaxie par Hemlibra versus un traitement préalable par agent by-passant
| Critère d'évaluation | Traitement préalable par agent by-passant* (N = 18) | Prophylaxie par Hemlibra (N = 18) |
| Saignements traités | ||
| ABR (IC à 95 %) | 19,8 (15,3 ; 25,7) | 0,4 (0,15 ; 0,88) |
| % reduction (RR) | 98 %0,02 | |
| % patients avec zéro saignement (IC à 95 %) | 5,6 (0,1 ; 27,3) | 77,8 (52,4 ; 93,6) |
| ABR moyen (EQ) | 16,2 (11,49 ; 25,78) | 0 (0 ; 0) |
| *
Traitement prophylactique antérieur pour 15 des 18 patients ;
traitement épisodique antérieur (« à la demande ») pour 3 patients. Le rapport des taux et l'intervalle de confiance (IC) provenant d'un modèle de régression binomiale négative (RBN) et la valeur de p sont calculés à l'aide d'un test de Wald stratifié, comparant le taux de saignement annualisé (ABR) entre les bras spécifiés. Données de comparaison intra-patient provenant de l'ENI. Seuls les patients qui ont participé à l'ENI et à l'étude HAVEN 2 sont inclus. Les définitions des saignements sont basées sur les critères de l'ISTH (International Society on Thrombosis and Haemostasis). Saignements traités : saignements traités par des agents by-passants. Les patients exposés à l'emicizumab ont commencé par la dose de charge de 3 mg/kg/semaine pendant 4 semaines. ABR : taux de saignement annualisé ; IC : intervalle de confiance ; RR= rapport des taux ; EI : intervalle interquartile, 25e percentile au 75e percentile. Bien qu'une meilleure adhérence au traitement prophylactique par emicizumab ait été observée par rapport à la prophylaxie antérieure par agents by-passants, aucune différence sur les taux de saignements annualisés n'a pu être identifiée pour les patients ayant été observants à ≥ 80% ou <80% de leur dose prophylactique d'agents by-passants selon les libellés d'AMM (les données doivent être interprétées avec prudence compte tenu des petites tailles d'échantillons). En raison de la courte demi-vie des agents by-passants, aucun effet résiduel n'est attendu après leur interruption. Seules les cinq premières doses d'emicizumab ont dû être administrées sous surveillance pour garantir la sécurité et la maîtrise de la technique d'injection. Comme pour la prophylaxie par agents by-passants, l'auto-administration à domicile était autorisée pour toutes les doses suivantes d'emicizumab. | ||
Résultats liés à l'état de santé en pédiatrie
Etude HAVEN 2 Résultats liés à l'état de santé
Dans l'étude HAVEN 2, la Qualité de Vie liée à la santé (QdV) chez les patients âgés de ≥ 8 à < 12 ans a été évaluée à la semaine 25 à l'aide du questionnaire Haemo-QoL-SF pour enfants (voir tableau 14). L'Haemo-QoL-SF est une mesure valide et fiable de la QdV.
La QdV des patients âgés de moins de 12 ans a également été évaluée à la semaine 25 à l'aide du questionnaire Adapted InhibQoL with Aspects of Caregiver Burden rempli par les aidants (voir tableau 14). L'InhibQoL adaptée est une mesure valide et fiable de la QdV.
Tableau 14 Etude HAVEN 2 : Changement depuis l'état initial à la semaine 25 du score de santé physique chez les patients (< 12 ans) après une prophylaxie par Hemlibra tel que rapporté par les patients et les aidants
| Haemo-QoL-SF | |
| Score de santé physique (intervalle de 0 à 100)a | |
| Score moyen initial (IC à 95 %) (n = 18) | 29,5 (16,4 - 42,7) |
| Changement moyen depuis l'état initial (IC à 95 %)(n = 15) | -21,7 (-37,1 - -6,3) |
| InhibQoL adapté avec les aspects de la charge des aidants | |
| Score de santé physique (intervalle de 0 à 100)a | |
| Score moyen initial (IC à 95 %) (n = 54) | 37,2 (31,5 - 42,8) |
| Changement moyen depuis l'état initial (IC à 95 %)(n = 43) | -32,4 (-38,6 - -26,2) |
| a Les scores inférieurs (changement négatifs de scores) reflètent un meilleur fonctionnement Les analyses sont basées sur des données provenant d'individus ayant fourni des réponses à l'évaluation initiale et à la semaine 25. | |
L'expérience sur l'utilisation d'agents by-passants ou FVIII au cours d'interventions chirurgicales et de gestes invasifs est limitée.
L'utilisation d'agents by-passants ou FVIII au cours d'interventions chirurgicales et de gestes invasifs a été effectuée à la discrétion de l'investigateur.
En cas de saignement intercurrent, les patients recevant l'emicizumab en prophylaxie doivent être traités par les traitements disponibles. Pour les recommandations sur les agents by-passants, voir rubrique Mises en garde spéciales et précautions d'emploi.
Immunogénicité
Comme avec toutes les protéines thérapeutiques, il existe un risque de réponse immunitaire chez les patients traités par emicizumab. Au total, 739 patients ont été testés vis-à-vis de la formation d'anticorps anti-emicizumab dans le cadre de l'ensemble des études cliniques. Trente-six patients (4,9 %) ont présenté des anticorps anti-emicizumab. Chez 19 patients (2,6 %), les anticorps anti- emicizumab étaient neutralisants in vitro. Sur ces 19 patients, les anticorps anti-emicizumab neutralisants n'ont pas eu d'impact cliniquement significatif sur la pharmacocinétique ou l'efficacité d'Hemlibra chez 15 patients, tandis qu'une diminution des concentrations plasmatiques d'emicizumab a été observée chez quatre patients (0,5 %). Un patient (0,1 %) présentant des anticorps anti-emicizumab neutralisants et une diminution des concentrations plasmatiques d'emicizumab a présenté une perte d'efficacité après cinq semaines de traitement et a arrêté Hemlibra. Dans l'ensemble, le profil de sécurité d'Hemlibra était similaire entre les patients présentant des anticorps anti-emicizumab (y compris des anticorps neutralisants) et ceux n'en présentant pas (voir rubriques Mises en garde spéciales et précautions d'emploi et Effets indésirables).
Population âgée
L'utilisation d'Hemlibra chez les patients âgés de 65 ans et plus atteints d'hémophilie A est soutenue par les études HAVEN 1, HAVEN 3, HAVEN 4 et HAVEN 6. D'après des données limitées, il n'existe pas de preuve indiquant une différence d'efficacité ou de tolérance chez les patients âgés de 65 ans ou plus.
Les propriétés pharmacocinétiques de l'emicizumab ont été déterminées à l'aide d'une analyse non compartimentale chez des sujets sains, et en utilisant une analyse pharmacocinétique de population sur une base de données composée de 389 patients atteints d'hémophilie A.
Absorption
Après une administration sous-cutanée chez des patients atteints d'hémophilie A, la demi-vie d'absorption a été de 1,6 jour.
Après les multiples injections sous-cutanées de 3 mg/kg une fois par semaine au cours des 4 premières semaines chez des patients atteints d'hémophilie A, les concentrations plasmatiques résiduelles moyennes (± ET) d'emicizumab ont atteint 52,6 ± 13,6 µg/mL lors de la semaine 5.
Les valeurs Cmin et Cmax moyennes prévues (±ET) et les rapports Cmax/Cmin à l'état d'équilibre pour les doses d'entretien recommandées de 1,5 mg/kg une fois par semaine, 3 mg/kg toutes les deux semaines ou 6 mg/kg toutes les quatre semaines sont indiqués dans le tableau 15.
Table 15 Concentrations moyennes (± écart-type) d'emicizumab à l'état d'équilibre
| Dose d'entretien | |||
| Paramètres | 1,5 mg/kg hebdomadaire | 3 mg/kg toutes les 2 semaines | 6 mg/kg toutes les 4 semaines |
| Cmax, eq (µg/mL) | 54,9±15,9 | 58,1±16,5 | 66,8±17,7 |
| Cmoy, eq (µg/mL) | 53,5 ±15,7 | 53,5 ±15,7 | 53,5 ±15,7 |
| Cmin, eq (µg/mL) | 51,1±15,3 | 46,7±16,9 | 38,3±14,3 |
| Cmax/Cmin | 1,08±0,03 | 1,26±0,12 | 1,85±0,46 |
| Cmoy, eq : concentration moyenne à l'état d'équilibre ; Cmax, eq : concentration maximale à l'état d'équilibre ; Cmin, eq : concentration minimale à l'état d'équilibre. Paramètres pharmacocinétiques dérivés du modèle pharmacocinétique de population. | |||
Des profils pharmacocinétiques similaires ont été observés après l'administration d'une dose hebdomadaire (3 mg/kg/semaine pendant 4 semaines, suivie de 1,5 mg/kg/semaine) chez des adultes/adolescents (≥ 12 ans) et des enfants (< 12 ans) (voir figure1).
Figure 1 : Concentration plasmatique moyenne (IC à ± 95 %) d'emicizumab en fonction du temps chez les patients âgés de ≥ 12 ans (études HAVEN 1 et HAVEN 3) comparés aux patients âgés de < 12 ans (étude HAVEN 2)
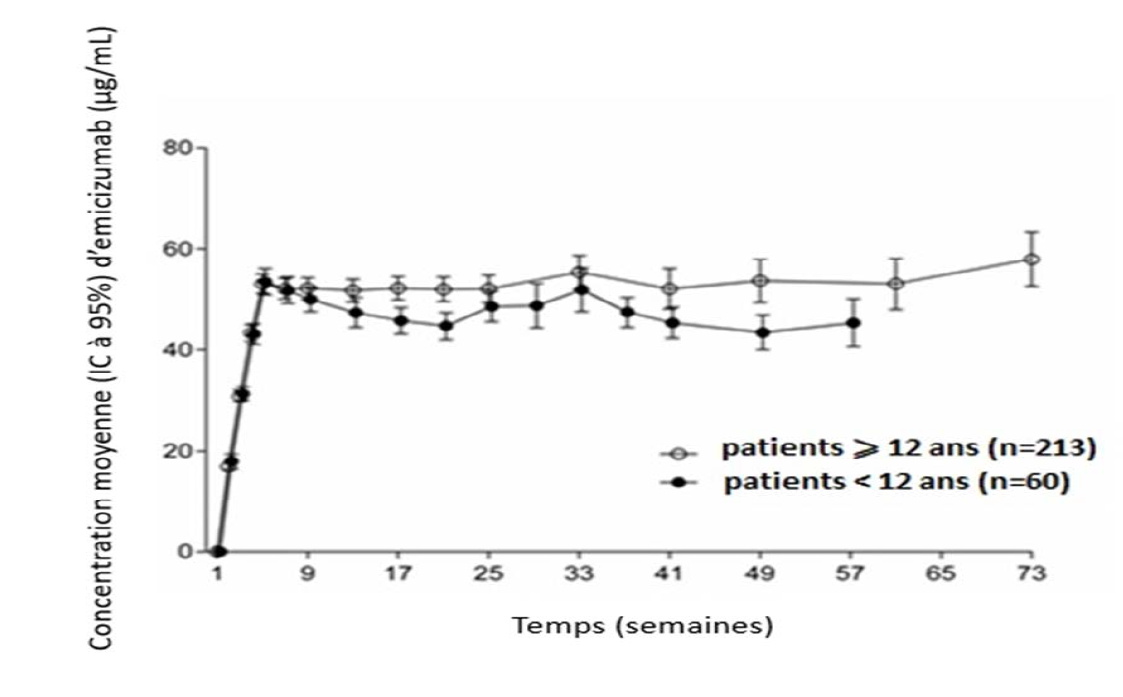
Chez des sujets sains, la biodisponibilité absolue après une administration sous-cutanée de 1 mg/kg a été comprise entre 80,4 % et 93,1 %, en fonction du site d'injection. Des profils pharmacocinétiques similaires ont été observés après une administration sous-cutanée au niveau de l'abdomen, de la partie supérieure du bras et de la cuisse. L'emicizumab peut être administré indifféremment sur ces sites anatomiques (voir rubrique Posologie et mode d'administration).
Distribution
Après une dose intraveineuse unique de 0,25 mg/kg d'emicizumab chez des sujets sains, le volume de distribution à l'état d'équilibre était de 106 mL/kg (c'est-à-dire 7,4 L pour un adulte de 70 kg).
Le volume de distribution apparent (V/F), estimé à partir de l'analyse pharmacocinétique de population, chez des patients atteints d'hémophilie A après de multiples doses sous-cutanées d'emicizumab a été de 10,4 L.
Biotransformation
Le métabolisme de l'emicizumab n'a pas été étudié. Les anticorps IgG sont principalement catabolisés par protéolyse lysosomale, puis sont éliminés ou réutilisés par l'organisme.
Élimination
Après une administration intraveineuse de 0,25 mg/kg chez des sujets sains, la clairance totale de l'emicizumab a été de 3,26 mL/kg/jour (c'est-à-dire 0,228 L/jour pour un adulte de 70 kg) et la demi- vie terminale moyenne a été de 26,7 jours.
Après une injection sous-cutanée unique chez des sujets sains, la demi-vie d'élimination a été d'environ 4 à 5 semaines.
Après de multiples injections sous-cutanées chez des patients atteints d'hémophilie A, la clairance apparente a été de 0,272 L/jour et la demi-vie d'élimination apparente de 26, 8 jours.
Linéarité de dose
L'emicizumab a montré des propriétés pharmacocinétiques proportionnelles à la dose chez les patients atteints d'hémophilie A sur un intervalle posologique compris entre 0,3 et 6 mg/kg, après la première dose d'Hemlibra. L'exposition (Cmoy eq) de doses multiples est comparable entre 1,5 mg/kg/semaine, 3 mg/kg toutes les 2 semaines et 6 mg/kg toutes les 4 semaines.
Populations particulières
Population pédiatrique
L'effet de l'âge sur les propriétés pharmacocinétiques d'emicizumab a été évalué dans une analyse pharmacocinétique de population ayant inclus 5 nourrissons (âgés de 1 mois à <2 ans), 55 enfants (âgés de moins de 12 ans) et 50 adolescents (âgés de 12 à <18 ans) atteints d'hémophilie A.
L'âge n'a pas affecté les propriétés pharmacocinétiques d'emicizumab dans la population pédiatrique.
Patients âgés
L'effet de l'âge sur les propriétés pharmacocinétiques d'emicizumab a été évalué dans une analyse pharmacocinétique de population ayant inclus treize sujets âgés de 65 ans et plus (aucun sujet n'était âgé de plus de 77 ans). La biodisponibilité relative a diminué avec l'âge, mais aucune différence cliniquement importante n'a été observée dans les propriétés pharmacocinétiques d'emicizumab entre les sujets âgés de moins de 65 ans et les sujets âgés de 65 ans et plus.
Origine ethnique
Les analyses pharmacocinétiques de population effectuées chez des patients atteints d'hémophilie A ont montré que l'origine ethnique n'affectait pas les propriétés pharmacocinétiques d'emicizumab. Aucun ajustement posologique n'est nécessaire pour ce facteur démographique.
Sexe
Les données disponibles chez les femmes sont trop limitées pour conclure.
Insuffisance rénale
Aucune étude spécifique sur l'effet de l'insuffisance rénale sur les propriétés pharmacocinétiques d'emicizumab n'a été réalisée.
Dans l'analyse pharmacocinétique de population, la majorité des patients atteints d'hémophilie A présentaient une fonction rénale normale (N = 332 ; clairance de la créatinine [CLcr] ≥ 90 mL/min) ou une insuffisance rénale légère (N = 27 ; CLcr de 60-89 mL/min). L'insuffisance rénale légère n'a pas impacté les propriétés pharmacocinétiques d'emicizumab.
Il existe des données limitées concernant l'utilisation d'Hemlibra chez les patients atteints d'insuffisance rénale modérée (seulement 2 patients présentant une CLcr de 30 à 59 mL/min), et aucune donnée chez les patients présentant une insuffisance rénale sévère. On ne peut pas conclure à l'impact de l'insuffisance rénale modérée et sévère sur les propriétés pharmacocinétiques d'emicizumab.
Emicizumab est un anticorps monoclonal qui est éliminé par catabolisme plutôt que par excrétion rénale, par conséquent un ajustement de la posologie ne devrait pas être nécessaire chez les patients présentant une insuffisance rénale.
Insuffisance hépatique
Aucune étude spécifique sur l'effet de l'insuffisance hépatique sur les propriétés pharmacocinétiques d'emicizumab n'a été réalisée. La plupart des patients présentant une hémophilie A dans l'analyse pharmacocinétique de population ont montré une fonction hépatique normale (bilirubine et ASAT ≤ LSN (limite supérieure à la normale), N = 300) ou une insuffisance hépatique légère (bilirubine ≤ LSN et ASAT > LSN ou bilirubine de 1,0 à 1,5 × LSN, quelle que soit la valeur de l'ASAT, N = 51).
Seulement 6 patients présentaient une insuffisance hépatique modérée (1,5 × LSN < bilirubine ≤3 × LSN et quelle que soit la valeur de l'ASAT).
Une insuffisance hépatique légère n'a pas affecté les propriétés pharmacocinétiques d'emicizumab (voir rubrique Posologie et mode d'administration). La sécurité et l'efficacité d'emicizumab n'ont pas été étudiées chez les patients présentant une insuffisance hépatique. Des patients présentant une insuffisance hépatique légère et modérée ont été inclus dans les études cliniques. Aucune donnée n'est disponible sur l'utilisation d'Hemlibra chez les patients présentant une insuffisance hépatique sévère.
Emicizumab est un anticorps monoclonal qui est éliminé par catabolisme plutôt que par métabolisme hépatique, par conséquent un ajustement de la posologie ne devrait pas être nécessaire chez les patients présentant une insuffisance hépatique.
Autres populations particulières
La modélisation montre que des doses moins fréquentes chez des patients présentant une hypoalbuminémie et un faible poids corporel pour leur âge entraînent une plus faible exposition à l'emicizumab ; les simulations indiquent que ces patients bénéficieraient toujours d'un contrôle des saignements cliniquement significatif. Aucun patient présentant de telles caractéristiques n'a été inclus dans les études cliniques.
Hemlibra n'a aucun effet ou un effet négligeable sur l'aptitude à conduire des véhicules et à utiliser des machines.
Les données précliniques ne révèlent aucun risque particulier chez l'homme sur la base des études de toxicité aiguë et en doses répétées, incluant les paramètres de pharmacologie de sécurité et de toxicologie de la reproduction.
Fertilité
Emicizumab n'a entraîné aucun changement sur les organes reproducteurs mâles et femelles chez des singes cynomolgus jusqu'à la dose maximale testée de 30 mg/kg/semaine (équivalent à 11 fois l'exposition humaine à la dose maximale de 3 mg/kg/semaine basée sur l'aire sous la courbe).
Tératogénicité
Aucune étude n'est disponible concernant les effets secondaires potentiels d'emicizumab sur le développement embryo-fœtal.
Réactions au site d'injection
Hémorragie d'évolution favorable, infiltration de cellules mononucléaires périvasculaires, dégénérescence / nécrose et inflammation de l'hypoderme ont été observées chez des animaux après injection sous-cutanée.
Hemlibra est une solution stérile, sans conservateur, prête à l'emploi destinée à une injection sous- cutanée, sans dilution préalable.
Hemlibra doit être inspecté visuellement afin de s'assurer de l'absence de particules ou de changement de couleur avant l'administration. Hemlibra est une solution incolore à légèrement jaune. La solution doit être éliminée si des particules visibles ou un changement de coloration du produit sont mis en évidence.
Ne pas agiter.
Les flacons de Hemlibra solution injectable sont à usage unique.
Une seringue, une aiguille de transfert avec filtre ou un adaptateur pour flacon avec filtre, et une aiguille d'injection sont nécessaires pour prélever la solution d'Hemlibra du flacon et l'injecter par voie sous-cutanée.
Veuillez voir ci-dessous les caractéristiques recommandées :
Une seringue de 1 mL doit être utilisée pour effectuer une injection d'un volume maximal de 1 mL de solution Hemlibra, tandis qu'une seringue de 2 à 3 mL doit être utilisée pour une injection d'un volume supérieur à 1 mL et jusqu'à 2 mL.
Reportez-vous aux "Instructions d'utilisation" d'Hemlibra pour les instructions de manipulation lors de la combinaison de flacons dans une seringue. Des flacons de différentes concentrations d'Hemlibra (30 mg/mL et 150 mg/mL) ne doivent pas être combinés en une seule injection pour administrer la dose prescrite.
Seringue de 1 mL
Critères : Seringue de polypropylène ou de polycarbonate transparente munie d'une extrémité Luer- lock, portant des graduations de 0,01 mL.
Seringue de 2 à 3 mL
Critères : Seringue de polypropylène ou de polycarbonate transparente munie d'une extrémité Luer- lock, portant des graduations de 0,1 mL.
Aiguille de transfert avec filtre
Critères pour l'aiguille de transfert avec filtre : En acier inoxydable, munie d'une connexion Luer- lock, de calibre 18 G, d'une longueur de 35 mm (1½?), contenant un filtre de 5 micromètres et de préférence à extrémité semi-émoussée.
Adaptateur pour flacon avec filtre
Critères pour l'adaptateur pour flacon avec filtre : En polypropylène, muni d'une connexion Luer- lock, intégrant un filtre de 5 micromètres, adaptable sur un flacon ayant un col de 15 mm de diamètre extérieur.
Aiguille d'injection
Critères : En acier inoxydable munie d'une connexion Luer-lock, de calibre 26 G (intervalle acceptable : 25-27 gauge), d'une longueur de préférence de 9 mm (3/8?) ou maximale de 13 mm (½?) comprenant de préférence un dispositif de sécurité.
Veuillez vous reporter à la rubrique Posologie et mode d'administration et à la notice (Section 7 Instructions d'utilisation), pour toute information complémentaire relative à l'administration.
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
Liste I
Prescription hospitalière
Solution injectable.
Solution incolore à légèrement jaune.
Un flacon de verre transparent de type I de 3 mL, avec un bouchon de caoutchouc butyle laminé avec un film de fluororésine et serti avec une capsule d’aluminium munie d’un disque plastique amovible violet.
Chaque flacon contient 60 mg
d’emicizumab dans 0,4 mL de solution injectable.
Chaque boîte contient un flacon.
Hemlibra 150 mg/mL solution injectable
Chaque mL de solution contient 150 mg d'emicizumab*
Chaque flacon de 0,4 mL contient 60 mg d'emicizumab à une concentration de 150 mg/mL.
* Emicizumab est un anticorps monoclonal humanisé de type immunoglobuline G4 (IgG4) modifiée, produit par la technologie de l'ADN recombinant dans des cellules d'ovaire de hamster chinois (chinese hamster ovary, CHO).
Pour la liste complète des excipients, voir rubrique Liste des excipients.
L-Arginine
L-Histidine
Acide L-Aspartique
Poloxamère 188
Eau pour préparations injectables
